¿Qué es el Cáncer?
«Cáncer» es un término genérico que designa un amplio grupo de enfermedades que pueden afectar a cualquier parte del cuerpo; también se habla de «tumores malignos» o «neoplasias malignas». Una característica del cáncer es la multiplicación rápida de células anormales que se extienden más allá de sus límites habituales y pueden invadir partes adyacentes del cuerpo o propagarse a otros órganos, proceso conocido como metástasis. Las metástasis son la principal causa de muerte por cáncer.
Datos y cifras
- El cáncer es una de las principales causas de enfermedad y mortalidad en todo el mundo; en esta década hubo unos 14 millones de nuevos casos y 8,2 millones de muertes relacionadas con el cáncer.
- Se prevé que el número de nuevos casos aumente en aproximadamente un 70% en los próximos 20 años.
- En la década actual, los cánceres diagnosticados con más frecuencia en el hombre fueron los de pulmón, próstata, colon y recto, estómago e hígado.
- En la mujer fueron los de mama, colon y recto, pulmón, cuello uterino y estómago.
Diagnóstico temprano
El conocimiento de los síntomas y signos iniciales (en el caso de cánceres como los de la piel, mama, colon y recto, cuello uterino o boca) es fundamental para que se puedan diagnosticar y tratar precozmente. El diagnóstico temprano es especialmente importantes cuando no hay métodos de cribado eficaces o, como ocurre en muchos entornos con escasos recursos, o no se aplican intervenciones de cribado y tratamiento. En ausencia de intervenciones de detección temprana o de cribado y tratamiento, los pacientes son diagnosticados en estadios muy tardíos, cuando yo no son posibles los tratamientos curativos.
Tratamiento
El diagnóstico correcto del cáncer es esencial para un tratamiento adecuado y eficaz, porque cada tipo de cáncer necesita un tratamiento específico que puede abarcar una o más modalidades, tales como la cirugía, la radioterapia o la quimioterapia. El objetivo principal radica en curar el cáncer o prolongar la vida de forma considerable. Otro objetivo importante consiste en mejorar la calidad de vida del paciente, lo cual se puede lograr con atención paliativa y apoyo psicológico.

¿Qué es el Cáncer?
«Cáncer» es un término genérico que designa un amplio grupo de enfermedades que pueden afectar a cualquier parte del cuerpo; también se habla de «tumores malignos» o «neoplasias malignas». Una característica del cáncer es la multiplicación rápida de células anormales que se extienden más allá de sus límites habituales y pueden invadir partes adyacentes del cuerpo o propagarse a otros órganos, proceso conocido como metástasis. Las metástasis son la principal causa de muerte por cáncer.
El cáncer comienza en una célula.
La transformación de una célula normal en tumoral es un proceso que ocurre en varias fases y suele consistir en la progresión de una lesión precancerosa a un tumor maligno. Estas alteraciones son el resultado de la interacción entre los factores genéticos del paciente y tres categorías de agentes externos, a saber:
- Carcinógenos físicos, como las radiaciones ultravioleta e ionizantes;
- Carcinógenos químicos, como los asbestos, los componentes del humo de tabaco, las aflatoxinas (contaminantes de los alimentos) o el arsénico (contaminante del agua de bebida);
- Carcinógenos biológicos, como las infecciones causadas por determinados virus, bacterias o parásitos.
A través de su Centro Internacional de Investigaciones sobre el Cáncer, la OMS mantiene una clasificación de los agentes cancerígenos.
El envejecimiento es otro factor fundamental en la aparición del cáncer. La aparición (incidencia) de esta enfermedad aumenta muchísimo con la edad, muy probablemente porque se van acumulando factores de riesgo de determinados tipos de cáncer. La acumulación general de factores de riesgo se combina con la tendencia que tienen los mecanismos de reparación celular a perder eficacia con la edad.
El consumo de tabaco y alcohol, la dieta malsana y la inactividad física son los principales factores de riesgo de cáncer en todo el mundo. Algunas infecciones crónicas también constituyen factores de riesgo, y son más importantes en los países de ingresos medios y bajos.
Los virus de las hepatitis B (VHB) y C (VHC) y algunos tipos de papiloma virus humanos (PVH) aumentan el riesgo de cáncer de hígado y cuello uterino, respectivamente. La infección por el VIH también aumenta considerablemente el riesgo de algunos cánceres, como los del cuello uterino.
- El cáncer es una de las principales causas de enfermedad y mortalidad en todo el mundo; en esta década hubo unos 14 millones de nuevos casos y 8,2 millones de muertes relacionadas con el cáncer.
- Se prevé que el número de nuevos casos aumente en aproximadamente un 70% en los próximos 20 años.
- En la década actual, los cánceres diagnosticados con más frecuencia en el hombre fueron los de pulmón, próstata, colon y recto, estómago e hígado.
- En la mujer fueron los de mama, colon y recto, pulmón, cuello uterino y estómago
- Aproximadamente un 30% de las muertes por cáncer son debidas a cinco factores de riesgo conductuales y dietéticos: índice de masa corporal elevado, ingesta reducida de frutas y verduras, falta de actividad física, consumo de tabaco y consumo de alcohol.
- El consumo de tabaco es el factor de riesgo más importante, y es la causa más del 20% de las muertes mundiales por cáncer en general, y alrededor del 70% de las muertes mundiales por cáncer de pulmón.
- Los cánceres causados por infecciones víricas, tales como las infecciones por virus de las hepatitis B (VHB) y C (VHC) o por papiloma virus humanos (PVH), son responsables de hasta un 20% de las muertes por cáncer en los países de ingresos bajos y medios.1
- Más del 60% de los nuevos casos anuales totales del mundo se producen en África, Asia, América Central y Sudamérica. Estas regiones representan el 70% de las muertes por cáncer en el mundo
- Se prevé que los casos anuales de cáncer aumentarán de 14 millones en 2012 a 22 millones en las próximas dos décadas.
El cáncer es la principal causa de muerte a escala mundial. Se le atribuyen 8,2 millones de defunciones ocurridas en todo el mundo en esta década.1 Los principales tipos de cáncer son los siguientes:
- Pulmonar (1,59 millones de defunciones)
- Hepático (745 000 defunciones)
- Gástrico (723 000 defunciones)
- Colorrectal (694 000) defunciones
- Mamario (521 000 defunciones)
- Cáncer de esófago (400 000 defunciones).
Se sabe mucho acerca de las causas del cáncer y las intervenciones para prevenirlo y tratarlo. Es posible reducir y controlar el cáncer aplicando estrategias de base científica destinadas a la prevención de la enfermedad así como a la detección temprana y al tratamiento de estos enfermos. Muchos cánceres tienen grandes probabilidades de curarse si se detectan tempranamente y se tratan de forma adecuada.
Más del 30% de las defunciones por cáncer podrían evitarse modificando o evitando los principales factores de riesgo, tales como:
- El consumo de tabaco
- El exceso de peso o la obesidad
- Las dietas malsanas con un consumo insuficiente de frutas y hortalizas
- La inactividad física
- El consumo de bebidas alcohólicas
- Las infecciones por PVH y VHB
- Radiaciones ionizantes y no ionizantes
- La contaminación del aire de las ciudades
- El humo generado en la vivienda por la quema de combustibles sólidos.
El consumo de tabaco es el factor de riesgo más importante, y es la causa de aproximadamente un 22% de las muertes mundiales por cáncer en general, y de acerca el 70% de las muertes mundiales por cáncer de pulmón. En muchos países de ingresos bajos, hasta un 20% de las muertes por cáncer son debidas a infecciones por VHB o PVH.
- Evitar los factores de riesgo recién enumerados
- Vacunar contra los PVH y el VHB
- Controlar los riesgos ocupacionales
- Reducir la exposición a la radiación no ionizante solar (ultravioleta)
- Reducir la exposición a la radiación ionizante (ocupacional o pruebas médicas radiológicas).
La mortalidad por cáncer se puede reducir si los casos se detectan y tratan a tiempo. Las actividades de detección temprana tienen dos componentes.
El conocimiento de los síntomas y signos iniciales (en el caso de cánceres como los de la piel, mama, colon y recto, cuello uterino o boca) es fundamental para que se puedan diagnosticar y tratar precozmente. El diagnóstico temprano es especialmente importantes cuando no hay métodos de cribado eficaces o, como ocurre en muchos entornos con escasos recursos, o no se aplican intervenciones de cribado y tratamiento. En ausencia de intervenciones de detección temprana o de cribado y tratamiento, los pacientes son diagnosticados en estadios muy tardíos, cuando yo no son posibles los tratamientos curativos.
El cribado o identificación de cuál es la población que tiene riesgo de contraer cáncer.
El cribado tiene por objeto descubrir a los pacientes que presentan anomalías indicativas de un cáncer determinado o de una lesión precancerosa y así poder diagnosticarlos y tratarlos prontamente. Los programas de cribado son especialmente eficaces en relación con tipos de cáncer frecuentes para los cuales existe una prueba de detección costo-eficaz, aceptable y accesible a la mayoría de la población en riesgo.
Estos son algunos ejemplos:
- La inspección visual con ácido acético para el cáncer cervicouterino en entornos con pocos recursos
- Pruebas de detección de PVH en el caso del cáncer cervicouterino
- El frotis de Papanicolaou para el cáncer cervicouterino en entornos con ingresos medios y altos
- La mamografía para el cáncer de mama en entornos con ingresos altos.
El diagnóstico correcto del cáncer es esencial para un tratamiento adecuado y eficaz, porque cada tipo de cáncer necesita un tratamiento específico que puede abarcar una o más modalidades, tales como la cirugía, la radioterapia o la quimioterapia. El objetivo principal radica en curar el cáncer o prolongar la vida de forma considerable. Otro objetivo importante consiste en mejorar la calidad de vida del paciente, lo cual se puede lograr con atención paliativa y apoyo psicológico.
Algunas de las formas más comunes de cáncer, como el mamario, el cervicouterino, el bucal o el colorrectal, tienen tasas de curación más elevadas cuando se detectan pronto y se tratan correctamente.
Algunos tipos de cáncer, a pesar de ser diseminados, como las leucemias y los linfomas en los niños o el seminoma testicular, tienen tasas de curación elevadas si se tratan adecuadamente.
Como su nombre indica, van dirigidos a aliviar, no a curar, los síntomas del cáncer. Pueden ayudar a los enfermos a vivir más confortablemente; se trata de una necesidad humanitaria urgente para las personas de todo el mundo aquejadas de cáncer u otras enfermedades crónicas mortales. Se necesitan sobre todo en lugares donde hay una gran proporción de enfermos en fase avanzada, que tienen pocas probabilidades de curarse.
Los cuidados paliativos pueden aliviar los problemas físicos, psicosociales y espirituales de más del 90% de los enfermos con cáncer avanzado.
Las estrategias eficaces de salud pública, que abarcan la asistencia comunitaria y en el propio hogar, son esenciales para ofrecer alivio del dolor y cuidados paliativos a los enfermos y a sus familias en los entornos con pocos recursos.
El tratamiento del dolor moderado a intenso causado por el cáncer, que aqueja a más del 80% de los enfermos oncológicos en fase terminal, requiere obligatoriamente una mejora del acceso a la morfina por vía oral.
Desde el año 2013, la OMS puso en marcha el Plan de Acción Global para la Prevención y el Control de las Enfermedades No Transmisibles 2013-2020 que tiene como objetivo reducir la mortalidad prematura por el 25% de cáncer, enfermedades cardiovasculares, diabetes y enfermedades respiratorias crónicas. Algunas de las metas de aplicación voluntaria son especialmente importantes para la prevención del cáncer, como la que propone reducir el consumo de tabaco en un 30% entre 2014 y 2025.
La OMS y el Centro Internacional de Investigaciones sobre el Cáncer colaboran con otras organizaciones que forman parte del Equipo de Tareas Interinstitucional de las Naciones Unidas sobre la Prevención y el Control de las Enfermedades No Transmisibles y con otros asociados a el fin de:
- Aumentar el compromiso político con la prevención y el control del cáncer
- Coordinar y llevar a cabo investigaciones sobre las causas del cáncer y los mecanismos de la carcinogénesis en el ser humano
- Efectuar un seguimiento de la carga de cáncer (como parte de la labor de la Iniciativa Mundial sobre Registros Oncológicos)
- Elaborar estrategias científicas de prevención y control del cáncer
- Generar y divulgar conocimientos para facilitar la aplicación de métodos de control del cáncer basados en datos científicos
- Elaborar normas e instrumentos para orientar la planificación y la ejecución de las intervenciones de prevención, detección temprana, tratamiento y atención
- Facilitar la formación de amplias redes mundiales, regionales y nacionales de asociados y expertos en el control del cáncer
- Fortalecer los sistemas de salud locales y nacionales para que presten servicios asistenciales y curativos a los pacientes con cáncer
- Prestar asistencia técnica para la transferencia rápida y eficaz de las prácticas óptimas a los países en desarrollo.
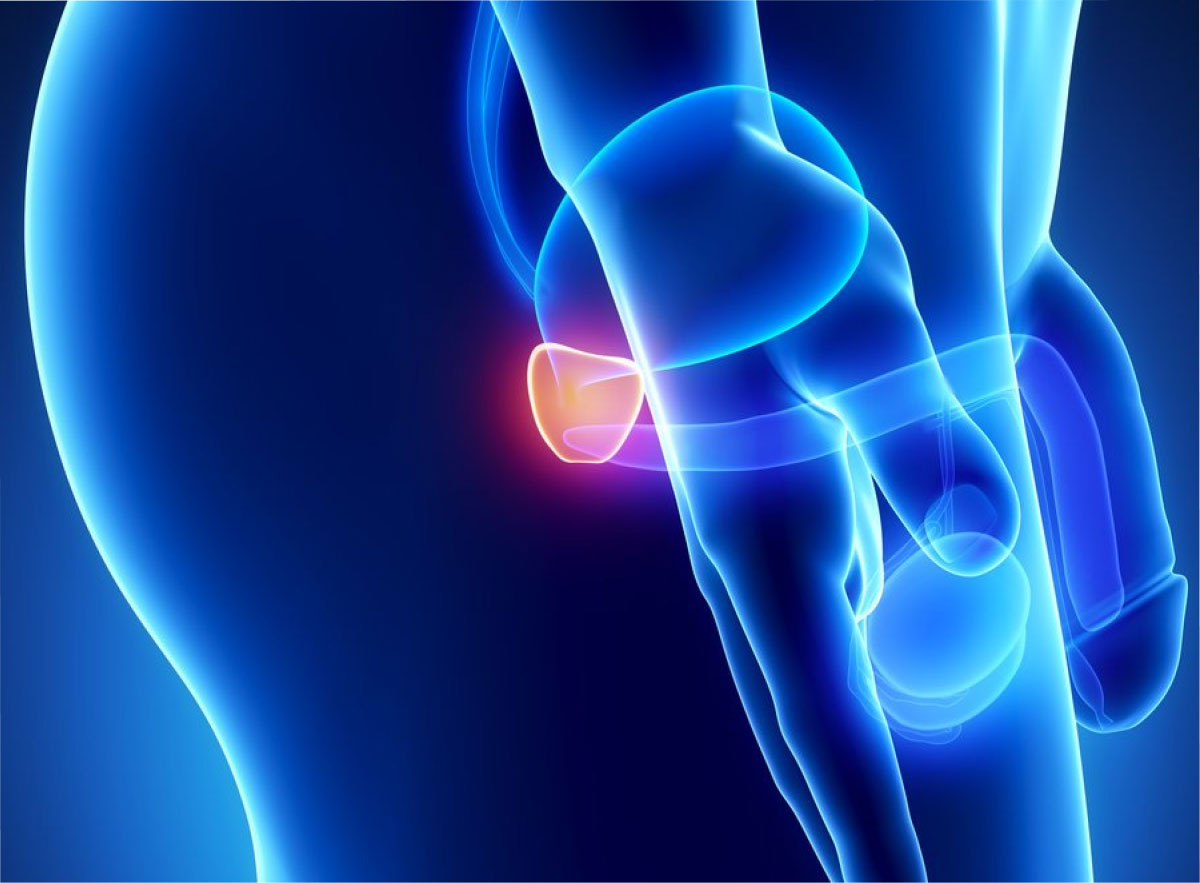
Cáncer de Próstata
¿Qué es el cáncer de próstata?
El cáncer se origina cuando las células en el cuerpo comienzan a crecer en forma descontrolada.
Las células en casi cualquier parte del cuerpo pueden convertirse en células cancerosas y pueden extenderse a otras áreas del cuerpo. El cáncer de próstata se origina cuando las células de la próstata comienzan a crecer sin control.
La próstata es una glándula que sólo tienen los hombres. Esta glándula produce parte del líquido que conforma el semen. La próstata se encuentra debajo de la vejiga y delante del recto. El tamaño de la próstata cambia con la edad. En los hombres más jóvenes, la próstata es del tamaño aproximado de una nuez. Sin embargo, puede ser mucho más grande en hombres de más edad. Justo detrás de la próstata se encuentran las glándulas llamadas vesículas seminales, las cuales producen la mayor parte del líquido del semen. La uretra, que es el conducto que transporta la orina y el semen fuera del cuerpo a través del pene, pasa por el centro de la próstata.
Estadísticas importantes
¿Qué tan común es el cáncer de próstata?
El cáncer de próstata es el cáncer más común después del cáncer de piel, en los hombres de los Estados Unidos. Para el año 2016, la Sociedad Americana Contra El Cáncer estima que, en los Estados Unidos:
• Se diagnosticarán alrededor de 180,890 casos nuevos de cáncer de próstata
• Se reportarán 26,120 muertes a causa del cáncer de próstata
Riesgo de cáncer de próstata
Aproximadamente uno de cada siete hombres será diagnosticado con cáncer de próstata en el transcurso de su vida.
El cáncer de próstata principalmente ocurre en los hombres de edad avanzada. Alrededor de seis de 10 casos se diagnostican en hombres de 65 años o más, y en pocas ocasiones se presenta antes de los 40 años. La edad promedio al momento de realizarse el diagnóstico es de aproximadamente 66 años.
¿Se puede prevenir el cáncer de próstata?
El cáncer de próstata no se puede prevenir de manera segura. Muchos factores de riesgo, tales como la edad, la raza, y el antecedente familiar no se pueden controlar. No obstante, existen algunas medidas que puede tomar para tratar de reducir su riesgo de padecer cáncer de próstata. Peso corporal, actividad física y alimentación, los efectos del peso corporal, la actividad física y la alimentación sobre el riesgo de cáncer de próstata no están claros, aunque usted puede tomar medidas que podrían reducir su riesgo, tal como:
• Coma al menos 2½ tazas de una gran variedad de verduras y frutas cada día
• Manténgase físicamente activo
• Mantenga un peso saludable
Para más información:
• Lea Guías de la Sociedad Americana Contra El Cáncer sobre Nutrición y Actividad Física para la Prevención del Cáncer.
• Consulte a su Médico y pregunte por Nuevos Productos Nutricionales Grado Farmacéutico.
Vitaminas, minerales y otros complementos
Algunos estudios preliminares han sugerido que tomar ciertos complementos vitamínicos o minerales, como la vitamina E o el selenio, pueden reducir el riesgo de padecer cáncer de próstata.
Medicamentos
Algunas medicinas tal vez puedan ayudar a reducir el riesgo de padecer cáncer de próstata.
Inhibidores de la 5-alfa reductasa
Aspirina
Otros medicamentos
Se están realizando actualmente estudios clínicos con otras medicinas y complementos alimenticios GRADO FARMACÉUTICO que podrían ayudar a reducir el riesgo de padecer cáncer de próstata, DISMINUIR EL ANTÍGENO PROSTÁTICO.
Para más información sobre estos temas de Prevención y Detección Temprana del Cáncer de Próstata, ver productos de Helsinn / GALA Pharma.
El cáncer se origina cuando las células en el cuerpo comienzan a crecer en forma descontrolada. Las células en casi cualquier parte del cuerpo pueden convertirse en células cancerosas y pueden extenderse a otras áreas del cuerpo. El cáncer de próstata se origina cuando las células de la próstata comienzan a crecer sin control. La próstata es una glándula que sólo tienen los hombres. Esta glándula produce parte del líquido que conforma el semen. La próstata se encuentra debajo de la vejiga y delante del recto. El tamaño de la próstata cambia con la edad. En los hombres más jóvenes, la próstata es del tamaño aproximado de una nuez. Sin embargo, puede ser mucho más grande en hombres de más edad. Justo detrás de la próstata se encuentran las glándulas llamadas vesículas seminales, las cuales producen la mayor parte del líquido del semen. La uretra, que es el conducto que transporta la orina y el semen fuera del cuerpo a través del pene, pasa por el centro de la próstata.
Casi todos los cánceres de próstata son adenocarcinomas. Estos cánceres se desarrollan a partir de las células de la glándula (las células que producen el líquido prostático que se agrega al semen).
- Sarcomas
- Carcinomas de células pequeñas
- Tumores neuroendocrinos (aparte de los carcinomas de células pequeñas)
- Carcinomas de células transicionales
Estos otros tipos de cáncer de próstata son poco comunes. Si usted tiene cáncer de próstata es casi seguro que sea un adenocarcinoma. Algunos cánceres de próstata pueden crecer y propagarse rápidamente, pero la mayoría crece lentamente. De hecho, los estudios realizados en algunas autopsias muestran que muchos hombres de edad avanzada (e incluso algunos hombres más jóvenes) que murieron por otras causas también tenían cáncer de próstata que nunca les afectó durante sus vidas. En muchos casos, ellos no sabían, y ni siquiera sus médicos, que tenían cáncer de próstata.
Algunos estudios sugieren que el cáncer de próstata comienza con una afección
precancerosa, aunque esto aún no se conoce con certeza. Estas afecciones se encuentran a veces cuando se le realiza una biopsia de la próstata a un hombre (extirpación de pequeños fragmentos de la próstata para detectar cáncer).
En la neoplasia prostática intraepitelial (prostatic intraepithelial neoplasia, PIN), hay
cambios microscópicos en la apariencia de la glándula prostática, pero las células
anormales no parecen invadir otras partes de la próstata (como sí lo harían las células
cancerosas). Basándose en cuán anormales se ven los patrones de las células, se clasifican de la siguiente forma:
- PIN de bajo grado: los patrones de las células de la próstata se ven casi normales.
- PIN de alto grado: los patrones de las células se ven más anormales.
En algunos hombres esta afección ya comienza a aparecer en la próstata desde los 20 a 29 años de edad. Muchos hombres comienzan a presentar una neoplasia de bajo grado cuando son jóvenes, pero no necesariamente padecen cáncer. El posible vínculo entre la neoplasia prostática intraepitelial de bajo grado y el cáncer de próstata aún no está claro. Si se encontró una neoplasia prostática intraepitelial de alto grado en la muestra de la próstata que se obtuvo mediante biopsia, hay aproximadamente 20% de probabilidades de que usted también tenga cáncer en otra área de la próstata.
En la atrofia inflamatoria proliferativa (proliferative inflammatory atrophy, PIA), las células de la próstata lucen más pequeñas de lo normal, y hay signos de inflamación en el área. La PIA no es cáncer, pero los investigadores creen que algunas veces puede convertirse en una PIN de alto grado o tal vez directamente en cáncer de próstata.
¿Qué tan común es el cáncer de próstata?
El cáncer de próstata es el cáncer más común después del cáncer de piel, en los hombres de los Estados Unidos. Para el año 2016, la Sociedad Americana Contra El Cáncer estima que, en los Estados Unidos:
- Se diagnosticarán alrededor de 180,890 casos nuevos de cáncer de próstata
- Se reportarán 26,120 muertes a causa del cáncer de próstata
Aproximadamente uno de cada siete hombres será diagnosticado con cáncer de próstata en el transcurso de su vida.
El cáncer de próstata principalmente ocurre en los hombres de edad avanzada. Alrededor de seis de 10 casos se diagnostican en hombres de 65 años o más, y en pocas ocasiones se presenta antes de los 40 años. La edad promedio al momento de realizarse el diagnóstico es de aproximadamente 66 años.
El cáncer de próstata es la segunda causa principal de muerte en los hombres de los
Estados Unidos, después del cáncer de pulmón. Aproximadamente uno de cada 39
hombres morirá por cáncer de próstata. En México las estadísticas no son precisas pero el comportamiento es muy similar.
El cáncer de próstata puede ser una enfermedad grave, aunque la mayoría de los hombres diagnosticados con este cáncer no muere a causa de esta enfermedad. De hecho, en los Estados Unidos, más de 2.9 millones de hombres que han sido diagnosticados con cáncer de próstata en algún momento, siguen vivos hoy en día.
Un factor de riesgo es todo aquello que afecta la probabilidad de que usted padezca una enfermedad como, por ejemplo, el cáncer. Los distintos tipos de cáncer tienen diferentes factores de riesgo. Algunos factores de riesgo, como el fumar, pueden cambiarse. Otros factores, como la edad de la persona o sus antecedentes familiares, no se pueden cambiar. Sin embargo, tener uno o incluso varios factores de riesgo no significa que usted padecerá la enfermedad. Muchas personas con uno o más factores de riesgo nunca padecen cáncer, mientras que otras que padecen la enfermedad puede que hayan tenido pocos factores de riesgo conocidos o ninguno de éstos. Los investigadores han descubierto varios factores de riesgo que pueden afectar el riesgo de que un hombre padezca cáncer de próstata.
Edad
Es poco común que el cáncer de próstata afecte a los hombres menores de 40 años, pero la probabilidad de padecer cáncer de próstata aumenta rápidamente después de los 50 años. Alrededor de 6 de 10 casos de cáncer de próstata se detectan en hombres mayores de 65 años.
Raza/grupo étnico
El cáncer de próstata ocurre con más frecuencia en los hombres de raza negra y en
hombres del Caribe con ascendencia africana que en los hombres de otras razas. Los
hombres de raza negra también tienen más del doble de probabilidades de fallecer debido al cáncer de la próstata que los hombres de raza blanca. El cáncer de próstata ocurre con menos frecuencia en los hombres asiático-americanos y en los hispanos/latinos que en los hombres blancos. No están claras las razones de estas diferencias raciales y étnicas.
Geografía
El cáncer de próstata es más común en Norteamérica y en la región noroeste de Europa, Australia, y en las islas del Caribe. Es menos común en Asia, África, Centroamérica y Sudamérica.
Las razones de esto no están claras. Es probable que el uso más intenso de pruebas de detección en algunos países desarrollados sea responsable por lo menos en parte de esta diferencia, pero también es probable que otros factores sean importantes, como diferencias en el estilo de vida (alimentación, etc.). Por ejemplo, los estadounidenses de origen asiático tienen un menor riesgo de cáncer de próstata que los estadounidenses blancos, pero el riesgo de ellos es mayor que el de los hombres que viven en Asia con antecedentes similares.
Antecedentes familiares
Parece ser que el cáncer de próstata afecta más a algunas familias, lo cual sugiere que en algunos casos puede haber un factor hereditario o genético. (Aun así, la mayoría de los cánceres de próstata ocurre en hombres que no tienen antecedentes familiares de este cáncer). Si el padre o el hermano de un hombre padecen cáncer de próstata, se duplica el riesgo de que este hombre padezca la enfermedad. (El riesgo es mayor para los hombres que tienen un hermano con la enfermedad que para aquellos con un padre que tiene este cáncer). Asimismo, el riesgo es mucho mayor en el caso de los hombres que tienen varios familiares afectados, particularmente si tales familiares eran jóvenes cuando se les encontró el cáncer.
Cambios genéticos
Varios cambios genéticos heredados parecen aumentar el riesgo de padecer cáncer de próstata, pero probablemente son sólo responsables de un pequeño porcentaje de casos en general. Por ejemplo:
- Las mutaciones hereditarias de los genes BRCA1 o BRCA2 aumentan el riesgo de padecer cánceres de seno y de ovario en algunas familias. Las mutaciones en estos genes (en particular en el BRCA2) también puede aumentar el riesgo de padecer cáncer de próstata en algunos hombres.
- Los hombres con el síndrome de Lynch (también conocido como cáncer colorrectal hereditario sin poliposis o HNPCC), una afección causada por cambios genéticos hereditarios, tienen un mayor riesgo de padecer varios tipos de cáncer, incluyendo el cáncer de próstata. Otros cambios genéticos hereditarios también pueden aumentar el riesgo de un hombre de padecer cáncer de próstata.
Alimentación
La función exacta que desempeña la alimentación en el desarrollo del cáncer de próstata no está clara, aunque se han estudiado varios factores.
Los hombres que comen muchas carnes rojas o productos lácteos altos en grasa parecen tener una probabilidad ligeramente mayor de cáncer de próstata. Estos hombres también tienden a comer menos alimentos de origen vegetal como frutas, ensaladas y verduras. Los médicos no han determinado cuál de estos factores es responsable del aumento en el riesgo.
Algunos estudios han sugerido que los hombres que consumen una gran cantidad de calcio (proveniente de alimentos o complementos) pueden tener un mayor riesgo de padecer un cáncer de próstata. Es posible que los productos lácteos (los cuales a menudo tienen mucho calcio) también puedan aumentar el riesgo. Sin embargo, la mayoría de los estudios no ha encontrado tal asociación con los niveles de calcio encontrados en una dieta promedio. Es importante indicar que se sabe que el calcio proporciona otros beneficios importantes para la salud.
Obesidad
La obesidad (sobrepeso en exceso) no parece aumentar el riesgo general de padecer cáncer de próstata. Sin embargo, algunos estudios han encontrado que los hombres obesos tienen un menor riesgo de una forma de la enfermedad de bajo grado (menos peligrosa), pero un mayor riesgo de un cáncer de próstata más agresivo. Las razones de esto no están claras. Algunos estudios también han encontrado que los hombres obesos pueden tener un mayor riesgo de padecer cáncer de próstata avanzado y de morir a causa de esta enfermedad, pero no todos los estudios han encontrado este vínculo.
Tabaquismo
La mayoría de los estudios no ha encontrado un vínculo entre el hábito de fumar y el cáncer de próstata. Algunas investigaciones han vinculado el fumar con un posible aumento pequeño en el riesgo de morir a causa de cáncer de próstata, aunque este hallazgo necesita ser confirmado por otros estudios.
Exposiciones a sustancias químicas
Cierta evidencia indica que los bomberos pueden estar expuestos a sustancias químicas que pueden aumentar el riesgo de padecer cáncer de próstata.
Algunos estudios han sugerido un posible vínculo entre la exposición al agente naranja, un producto químico ampliamente utilizado durante la guerra de Vietnam y el riesgo de cáncer de próstata, aunque no todos los estudios han encontrado tal vínculo. La Academia Nacional de Medicina considera que hay “evidencia limitada/sugestiva” de un vínculo entre la exposición al agente naranja y el cáncer de próstata. Para más información, lea Agent Orange and Cancer.
Inflamación de la próstata
Algunos estudios han sugerido que la prostatitis (inflamación de la glándula prostática) puede estar asociada a un riesgo aumentado de cáncer de próstata, aunque otros estudios no han encontrado tal asociación. A menudo, la inflamación se observa en las muestras del tejido de la próstata que también contiene cáncer. La asociación entre los dos no está clara, y es un área activa de investigación.
Infecciones de transmisión sexual
Los investigadores han estudiado si las infecciones de transmisión sexual (como gonorrea o clamidia) podrían aumentar el riesgo de cáncer de próstata, porque pueden causar inflamación de la próstata. Hasta el momento, los estudios no han concordado, y no se han logrado conclusiones sólidas.
Vasectomía
Algunos estudios han sugerido que los hombres que se han sometido a una vasectomía (cirugía menor para volverse estériles) presentan un riesgo ligeramente mayor de cáncer de próstata, aunque otros estudios no han encontrado esto. Se sigue realizando investigación sobre este posible vínculo.
Los investigadores desconocen exactamente qué causa el cáncer de próstata. Sin embargo, los investigadores han encontrado algunos factores de riesgo y han logrado avanzar en el entendimiento de cómo estos factores causan que las células de la glándula prostática se conviertan en cáncer. En términos generales, el cáncer de próstata es causado por cambios en el ADN de una célula normal de la próstata. El ADN es el producto químico de nuestras células que conforma nuestros genes. Nuestros genes controlan cómo funcionan nuestras células. Por lo general, nos asemejamos a nuestros padres porque de ellos proviene nuestro ADN. Sin embargo, el ADN afecta algo más que sólo nuestra apariencia. Algunos genes controlan cuándo crecen nuestras células, cuándo se dividen para formar nuevas células y cuándo mueren:
- A ciertos genes que ayudan a las células a crecer, dividirse y a mantenerse vivas se les denominan oncogenes.
- Los genes que normalmente mantienen el control del crecimiento celular, reparan los errores en el ADN, o que provocan que las células mueran en el momento oportuno se llaman genes supresores de tumores.
El cáncer puede ser causado en parte por cambios en el ADN (mutaciones) que activan a los oncogenes o desactivan a los genes supresores de tumores.
Los cambios en el ADN pueden ser heredados de uno de los padres o pueden ser adquiridos durante la vida de una persona.
Algunas mutaciones genéticas pueden ser transmitidas de una generación a otra, y se encuentran en todas las células del cuerpo. Estas mutaciones son hereditarias. Los cambios genéticos hereditarios causan aproximadamente de 5% a 10% de los cánceres de próstata. El cáncer causado por genes hereditarios se denomina cáncer hereditario. Varios genes mutados heredados han sido vinculados al cáncer de próstata, incluyendo:
RNASEL (anteriormente HPC1):
La función normal de este gen supresor de tumores consiste en ayudar a las células a morir cuando algo anda mal en su interior. Las mutaciones hereditarias en este gen podrían permitir que las células anormales vivan más tiempo de lo que deberían, lo que puede dar lugar a un mayor riesgo de cáncer de próstata.
BRCA1 y BRCA2:
Estos genes supresores de tumores normalmente ayudan a reparar errores en el ADN de una célula (o provocan que la célula muera si el error no se puede corregir). Las mutaciones hereditarias en estos genes causan más comúnmente cáncer de seno y de ovario en las mujeres. Sin embargo, los cambios en estos genes (especialmente BRCA2) también son responsables de un pequeño número de cánceres de próstata.
Genes de reparación de discordancias de ADN (tal como MSH2 y MLH1): estos genes normalmente ayudan a corregir errores (discordancias) en el ADN que se cometen cuando una célula se está preparando para dividirse en dos nuevas células. (Las células deben hacer una copia nueva de su ADN cada vez que se dividen). Los hombres con mutaciones hereditarias en estos genes tienen una condición conocida como síndrome de Lynch (también conocida como cáncer colorrectal hereditario sin poliposis (HNPCC, y tienen un mayor riesgo de padecer cáncer colorrectal, próstata y otros tipos de cáncer.
HOXB13:
Este gen es importante en el desarrollo de la glándula prostática. Las mutaciones en este gen han sido vinculadas al comienzo temprano del cáncer de próstata (cáncer de próstata diagnosticado a una edad temprana) que tiende a darse en algunas familias. Afortunadamente, esta mutación es poco común.
Otras mutaciones genéticas hereditarias pueden ser responsables de algunos tipos de cáncer de próstata hereditarios, y se están realizando investigaciones para encontrar estos genes.
Mutaciones genéticas adquiridas
Algunas mutaciones ocurren durante la vida de una persona y no son trasmitidas a los hijos. Estos cambios se detectan solamente en las células que provienen de la célula original que mutó. A estos cambios se les denominan mutaciones adquiridas. La mayoría de las mutaciones genéticas relacionadas con el cáncer de próstata no parecen ser hereditarias, sino que se forman durante el transcurso de la vida de un hombre. Cada vez que una célula se prepara para dividirse en dos nuevas células debe copiar su ADN. Este proceso no es perfecto y algunas veces ocurren errores, lo que deja al ADN con defectos en la célula nueva. No está claro con qué frecuencia estos cambios del ADN se deben a eventos aleatorios, ni con qué frecuencia son influenciados por otros factores (tal como alimentación, niveles hormonales, etc.). En general, entre más rápido las células crecen y se dividen, mayores son las probabilidades de que ocurran las mutaciones. Por lo tanto, cualquier cosa que adelante este proceso puede hacer que el cáncer de próstata sea más probable.
Por ejemplo, los andrógenos (hormonas masculinas), como la testosterona, promueven el crecimiento celular prostático. Tener niveles más altos de andrógenos puede contribuir al riesgo de cáncer de próstata en algunos hombres.
Algunas investigaciones han descubierto que los hombres que presentan altos niveles de otra hormona, el factor de crecimiento análogo a la insulina -1 (IGF1), tienen más probabilidades de padecer cáncer de próstata. Sin embargo, otros estudios no han encontrado tal asociación. Se necesita más investigación para comprender estos hallazgos. Como se mencionó en “Factores de riesgo del cáncer de próstata”, algunos estudios han encontrado que la inflamación en la próstata puede contribuir a la aparición del cáncer de próstata. Una teoría consiste en que la inflamación puede ocasionar daño del ADN de la célula, lo que puede contribuir a que una célula normal se convierta en cancerosa. Aún se necesita investigar más al respecto.
La exposición a la radiación o a las sustancias químicas cancerígenas puede causar mutaciones en el ADN de muchos órganos, pero no se ha comprobado que estos factores sean causas importantes de mutaciones en las células de la próstata.
El cáncer de próstata no se puede prevenir de manera segura. Muchos factores de riesgo, tales como la edad, la raza, y el antecedente familiar no se pueden controlar. No obstante, existen algunas medidas que puede tomar para tratar de reducir su riesgo de padecer cáncer de próstata. Peso corporal, actividad física y alimentación.
Los efectos del peso corporal, la actividad física y la alimentación sobre el riesgo de cáncer de próstata no están claros, aunque usted puede tomar medidas que podrían reducir su riesgo, tal como:
- Coma al menos 2½ tazas de una gran variedad de verduras y frutas cada día Manténgase físicamente activo
- Mantenga un peso saludable
Para más información
- Lea Guías de la Sociedad Americana Contra El Cáncer sobre nutrición y actividad física para la prevención del cáncer.
- Consulte a su Médico y pregunte por Nuevos Productos Nutricionales Grado Farmacéutico.
Algunos estudios preliminares han sugerido que tomar ciertos complementos vitamínicos o minerales, como la vitamina E o el selenio, pueden reducir el riesgo de padecer cáncer de próstata. Sin embargo, en un estudio extenso, no se encontró que la vitamina E ni el selenio redujeran el riesgo de cáncer de próstata.
Varios estudios actualmente investigan los posibles efectos de la proteína de soya (llamada isoflavonas) en el riesgo de padecer cáncer de próstata. Los resultados de estos estudios todavía no están disponibles. Cualquier complemento tiene el potencial de causar riesgos y beneficios. Antes de comenzar a tomar vitaminas u otros complementos, consulte con su médico.
Algunas medicinas tal vez puedan ayudar a reducir el riesgo de padecer cáncer de próstata.
Inhibidores de la 5-alfa reductasa
Los medicamentos finasterida (Proscar) y dutasterida (Avodart) han sido estudiados para saber si pueden reducir el riesgo de padecer cáncer de próstata, pero no está claro si los beneficios superan los riesgos en la mayoría de los hombres. Aun así, los hombres que quieran saber más sobre el uso de estos medicamentos deben consultar con sus médicos. Estos medicamentos se utilizan actualmente para tratar la hiperplasia prostática benigna (benign prostatic hyperplasia, BPH), un crecimiento no canceroso de la próstata.
Aspirina
Algunas investigaciones sugieren que los hombres que toman aspirina diariamente podrían presentar un menor riesgo de padecer y morir a causa de cáncer de próstata. No obstante, se necesitan más investigaciones para demostrar si los posibles beneficios superan a los riesgos, como un mayor riesgo de sangrado.
OTROS MEDICAMENTOS
Se están realizando actualmente estudios clínicos con otras medicinas y complementos alimenticios GRADO FARMACÉUTICO que podrían ayudar a reducir el riesgo de padecer cáncer de próstata, DISMINUIR EL ANTÍGENO PROSTÁTICO. (ver productos de Helsinn / Galapharma)
Para más información sobre estos temas, lea Prevención y detección temprana del cáncer de próstata.
Las pruebas de detección tienen el objetivo de descubrir cáncer antes de que se presente algún síntoma. Para algunos tipos de cáncer, las pruebas de detección pueden ayudar a encontrar cánceres en una etapa inicial cuando probablemente sean más fáciles de tratar. Frecuentemente se puede encontrar el cáncer de próstata antes de que surjan síntomas mediante el análisis de la cantidad de antígeno prostático específico (prostate-specific antigen, PSA) en la sangre de un hombre. El cáncer de próstata también se puede encontrar durante un examen digital del recto o tacto rectal (digital rectal exam, DRE). En este examen, el médico se coloca un guante lubricado para insertar un dedo en el recto y palpar la glándula prostática. Estas pruebas se describen detalladamente en Prevención y detección temprana del cáncer de próstata. Si los resultados de una de estas pruebas son anormales, se realizan pruebas adicionales para saber si un hombre tiene cáncer. Si se encuentra cáncer de próstata mediante las pruebas de detección PSA o DRE, probablemente el cáncer se encontrará en una etapa más temprana y más tratable que la etapa de un cáncer que no hubiese sido detectado precozmente con estas pruebas.
Las pruebas de detección definitivamente pueden ayudar a encontrar muchos cánceres de próstata en etapa temprana, pero aún no está claro si los beneficios de las pruebas superan a los riesgos en la mayoría de los hombres. Hoy día, las pruebas de detección que se utilizan para el cáncer de próstata presentan claramente tanto beneficios como desventajas.
Actualmente, la Sociedad Americana Contra El Cáncer recomienda que los hombres que estén considerando las pruebas de detección del cáncer de próstata deben tomar decisiones fundadas en la información disponible, el diálogo con sus médicos y sus opiniones sobre los posibles beneficios, riesgos y limitaciones de las pruebas de detección. Para más información sobre las guías de detección para el cáncer de próstata de la Sociedad Americana Contra El Cáncer, lea Prevención y detección temprana del cáncer de próstata.
Signos y síntomas del cáncer de próstata
Por lo general, el cáncer de próstata en etapa inicial no causa síntomas. Los cánceres de próstata más avanzados a veces causan síntomas, como:
- Problemas al orinar, incluyendo un flujo urinario lento o debilitado o necesidad de orinar con más frecuencia, especialmente de noche
- Sangre en la orina o el semen
- Dificultad para lograr una erección (disfunción eréctil)
- Dolor en las caderas, la espalda (columna vertebral), el tórax (costillas) u otras áreas debido a que el cáncer que se ha propagado a los huesos
- Debilidad o adormecimiento de las piernas o los pies, o incluso pérdida del control de la vejiga o los intestinos debido a que el cáncer comprime la médula espinal
Es más probable que la mayoría de estos problemas sean por causa distinta al cáncer de próstata. Por ejemplo, la hiperplasia prostática benigna (un crecimiento no canceroso de la próstata) causa dificultad para orinar con mucha más frecuencia que el cáncer. Aun así, resulta importante que usted le informe a su médico si presenta cualquiera de estos síntomas para que la causa se encuentre y se trate, de ser necesario.
Pruebas para detectar el cáncer de próstata
La mayoría de los cánceres de próstata se detecta primero mediante la prueba sanguínea del antígeno prostático específico (prostate-specific antigen, PSA) o el tacto rectal (digital rectal exam, DRE). (Lea Prevención y detección temprana del cáncer de próstata). Por lo general, los cánceres de próstata en etapas iniciales no causan síntomas, en cambio los cánceres más avanzados se pueden detectar debido a los síntomas que causan. Si se sospecha cáncer basándose en los resultados de las pruebas de detección o en los síntomas, será necesario realizar pruebas para confirmar el diagnóstico. El diagnóstico definitivo de cáncer de próstata se puede llevar a cabo únicamente mediante una biopsia de la próstata.
Antecedentes médicos y examen físico
Si su médico sospecha que usted tiene cáncer de próstata, él o ella le preguntará si presenta síntomas, tales como problemas urinarios o sexuales, y el tiempo que los lleva presentando. Puede que también le pregunte acerca de posibles factores de riesgo, incluyendo sus antecedentes familiares. Además, su doctor realizará una revisión médica que puede incluir un tacto rectal (digital rectal exam o DRE, en inglés). Para este examen, el doctor introducirá en el recto un dedo cubierto con un guante lubricado a fin de palpar cualquier abultamiento o área firme en la próstata que pueda ser cáncer. Si usted tiene cáncer, algunas veces el DRE puede ayudar a indicar si el cáncer se encuentra en un solo lado de la próstata, o en ambos lados, o si hay probabilidades de que se haya propagado de la glándula prostática a los tejidos cercanos.
Su médico también puede examinar otras áreas de su cuerpo, y puede ordenar algunas pruebas.
Prueba de PSA en sangre
La prueba de sangre del antígeno prostático específico (PSA) se usa principalmente para detectar el cáncer de próstata en los hombres que no presentan síntomas (lea Prevención y detección temprana del cáncer de próstata). También es una de las primeras pruebas realizadas en los hombres que presentan síntomas que podrían ser causados por cáncer de próstata.
La mayoría de los hombres sin cáncer de próstata tiene niveles de PSA menores a 4 nanogramos (ng/mL) por mililitro de sangre. La probabilidad de tener cáncer de próstata aumenta a medida que el nivel de PSA sube.
Cuando se forma el cáncer de próstata, el nivel de PSA generalmente aumenta a más de 4 nanogramos. Sin embargo, un nivel por debajo de 4 no garantiza que un hombre no tenga cáncer. Alrededor del 15% de los hombres que tienen un PSA menor de 4 presentarácáncer de próstata en una biopsia.
Los hombres que tienen un nivel de PSA de 4 a 10 tienen una probabilidad de 1 en 4 de padecer cáncer de próstata. Si el PSA es mayor de 10, la probabilidad de tener cáncer de próstata es de más de 50%.
No todos los médicos usan el mismo valor límite de PSA para decidir cuándo se debe
hacer una biopsia de la próstata. Si el PSA es de 4 o más, algunos médicos pueden recomendar la biopsia, mientras que otros pueden recomendarla comenzando a un nivel más bajo, como 2.5 o 3. También otros factores pueden afectar esta decisión, tales como la edad, la raza, y el antecedente familiar.
La prueba de PSA también puede ser útil si usted ya recibió un diagnóstico de cáncer de próstata.
- En los hombres que acaban de ser diagnosticados con cáncer de próstata, la prueba del PSA se puede usar junto con los resultados del examen físico y el grado tumoral (determinado en la biopsia, descrito más adelante) para ayudar a decidir si se requieren otras pruebas (tal como tomografía computarizada o gammagrafías óseas).
- La prueba de PSA es parte de la estadificación o estadiaje (el proceso de determinar la etapa del cáncer) y puede ayudar a indicar si es probable que su cáncer siga limitado a la próstata. Si su nivel de PSA es muy alto, es más probable que su cáncer se haya propagado fuera de la próstata. Esto podría afectar sus opciones de tratamiento, ya que es probable que algunas formas de tratamiento (como la cirugía y la radiación) no sean útiles si el cáncer se ha propagado a los ganglios linfáticos, a los huesos o a otros órganos.
- Las pruebas de PSA también son una parte importante en la evaluación del cáncer de próstata durante y después del tratamiento (lea Seguimiento de los niveles de PSA durante y después del tratamiento.
Ecografía transrectal
Para realizar la ecografía transrectal (transrectal ultrasound, TRUS), se lubrica y coloca una pequeña sonda de aproximadamente el ancho de un dedo en su recto. Esta sonda libera ondas de sonido que entran en la próstata y crean ecos. La sonda detecta los ecos y una computadora entonces las convierte en una imagen en blanco y negro de la próstata. A menudo, el procedimiento sólo dura unos 10 minutos y se puede realizar en el consultorio del médico o en una clínica ambulatoria. Usted sentirá algo de presión durante la introducción de la sonda, pero usualmente este procedimiento no causa dolor. Se puede adormecer el área antes de realizar el procedimiento. La TRUS a menudo se usa para examinar la próstata cuando un hombre presenta un alto nivel de PSA o un resultado de DRE anormal. También se usa durante una biopsia de la próstata para guiar las agujas al área correcta de la próstata. La TRUS también es útil en otras situaciones. Se puede emplear para medir el tamaño de la glándula prostática, lo que puede ayudar a determinar la densidad del PSA (descrito en Prevención y detección temprana del cáncer de próstata) y también puede influir en las opciones de tratamiento del paciente. Además, la TRUS se usa como una guía durante algunas formas de tratamiento, tal como braquiterapia (radioterapia interna) o crioterapia.
Biopsia de la próstata
Si ciertos síntomas o los resultados de las pruebas, como la prueba de sangre PSA o el examen digital del recto, sugieren que usted puede tener cáncer de próstata, su médico hará una biopsia de la próstata. Una biopsia es un procedimiento para extraer pequeñas muestras de la próstata y luego examinarlas al microscopio. Una biopsia por punción con aguja gruesa es el principal método usado para diagnosticar el cáncer de próstata. Por lo general, un urólogo realiza la biopsia, quien es un cirujano que trata los cánceres del tracto genitourinario, incluyendo la glándula prostática. El médico emplea la TRUS para “observar” la glándula prostática e insertar rápidamente una aguja delgada y hueca a través de la pared del recto hasta alcanzar la próstata. Al retirar la aguja, se extrae un pequeño cilindro de tejido prostático. Esto se repite varias veces. La mayoría de los urólogos tomará alrededor de 12 muestras cilíndricas de diferentes partes de la próstata. Aunque el procedimiento parece doloroso, por lo general cada biopsia solo causa una sensación desagradable breve debido a que se hace con un instrumento especial de biopsia con resorte automático. Este dispositivo introduce y retira la aguja en fracciones de segundo. La mayoría de los médicos que realiza la biopsia adormecerán el área primero al inyectar un anestésico local al lado de la próstata. Sería bueno que le pregunte a su médico si él o ella planea hacer esto.
La biopsia por sí sola dura aproximadamente 10 minutos y por lo general se realiza en el consultorio del médico. Es probable que se le administren antibióticos antes de la biopsia, y posiblemente por un día o dos después del procedimiento para reducir el riesgo de infección. Unos pocos días después del procedimiento, usted puede sentir cierta molestia en el área y puede notar sangre en su orina. Además puede sangrar un poco por el recto, especialmente si tiene hemorroides. Muchos hombres observan sangre en el semen o semen de color del metal oxidado, lo que puede durar por algunas semanas después de la biopsia (dependiendo de cuán frecuentemente eyacule). Las muestras obtenidas por medio de la biopsia se enviarán a un laboratorio para observarse con un microscopio y ver si contiene células cancerosas. Si se observa cáncer, también se le asignará un grado (vea la próxima sección). Usualmente los resultados (presentados en un informe de patología) están disponibles de uno a tres días, aunque a veces podría tomar más tiempo.
Aun cuando se toman muchas muestras, las biopsias pueden algunas veces pasar por alto el cáncer si ninguna de las agujas de la biopsia lo alcanza. Esto se conoce como resultado negativo falso. Si su médico sigue teniendo mucha sospecha de que usted tiene cáncer de próstata (por ejemplo, debido a que su PSA está muy elevado), es posible que sea necesario repetir la biopsia para ayudar a confirmar si hay o no cáncer.
Grado (puntación Gleason) del cáncer de próstata
A los cánceres de próstata se les asigna un grado según el sistema de Gleason. Este sistema asigna un grado Gleason basándose en cuánto se parece el cáncer al tejido normal de la próstata.
- Si el cáncer se parece mucho al tejido prostático normal, se le asigna un grado 1.
- Si el cáncer luce muy anormal, se le asigna un grado 5.
- Los grados 2 al 4 tienen características entre estos extremos.
La mayoría de los cánceres son grado 3 o más, y los grados 1 y 2 no se usan con frecuencia. Debido a que los cánceres de próstata a menudo tienen áreas con diferentes grados, se asigna un grado a las dos áreas que forman la mayor parte del cáncer. Estos dos grados se suman para obtener una puntación Gleason (también llamada “escala de Gleason”). Existen algunas excepciones a esta regla. Si el grado más alto compone la mayoría de la muestra de la biopsia (95% o más), el grado para esa área se cuenta doble en la puntuación Gleason. Además, si hay 3 grados en una biopsia por punción, el grado más alto siempre se incluye en la puntuación Gleason, incluso si la mayor parte de la muestra cilíndrica de tejido está compuesta por áreas de cáncer con grados menores. La puntuación Gleason puede ser entre 2 y 10, aunque en la mayoría de las biopsias es de al menos un 6. Cuánto más alto sea la puntuación Gleason, más probable es que su cáncer crezca y se propague rápidamente. Además de la puntuación Gleason, a veces se usan otros términos para indicar el grado del cáncer:
- A los cánceres con puntuación Gleason de 6 o menos, se les puede llamar cánceres bien diferenciados o de bajo grado.
- A los cánceres con puntuación Gleason 7 se les llama cánceres moderadamente diferenciados o de grado intermedio.
- A los cánceres con puntuación Gleason de 8 a 10 se les llama cánceres pobremente diferenciados o de alto grado.
Otra información en un informe de patología
Junto con el grado del cáncer (si está presente), el informe de patología a menudo contiene otra información sobre el cáncer, como:
- El número de muestras de biopsia por punción que contiene cáncer (por ejemplo, “7 de 12”).
- El porcentaje de cáncer en cada una de las muestras.
- Si el cáncer está en un lado (izquierdo o derecho) de la próstata o en ambos lados (bilateral).
Resultados sospechosos
Algunas veces, cuando se observan las células prostáticas, éstas no parecen ser cáncer, pero tampoco se ven normales. A menudo, estos resultados se catalogan como sospechosos.
Neoplasia prostática intraepitelial: en la neoplasia prostática intraepitelial (prostatic intrepithelial neoplasia, PIN), hay cambios en la apariencia de las células de la glándula prostática, pero las células anormales no parecen estar invadiendo otras partes de la próstata (como sí lo harían las células cancerosas). La PIN a menudo se divide en dos grupos:
- PIN de bajo grado: los patrones de las células de la próstata se ven casi normales.
- PIN de alto grado: los patrones de las células se ven más anormales.
Muchos hombres comienzan a presentar una neoplasia de bajo grado a una edad temprana, pero no necesariamente padecerán cáncer. Aún no está clara la importancia de la neoplasia prostática intraepitelial de bajo grado con respecto al cáncer de próstata. Si en una biopsia de la próstata se reporta un hallazgo de PIN de bajo grado, el seguimiento para los pacientes usualmente es el mismo al que se daría si nada anormal se hubiese reportado. Si en la biopsia se encuentra una neoplasia prostática intraepitelial de alto grado, hay una probabilidad aproximada de 20% de que el cáncer ya esté presente en algún lugar de la próstata. Por esta razón, los médicos a menudo observan cuidadosamente a los hombres con neoplasia prostática intraepitelial de alto grado y pueden recomendar la repetición de una biopsia de la próstata, especialmente si la biopsia original no tomó muestras de todas las partes de la glándula.
Proliferación microacinar atípica:
Algunas veces simplemente se denomina como atipia. En la proliferación microacinar atípica (atypical small acinar proliferation, ASAP), las células parecen ser cancerosas cuando se observan con un microscopio, pero hay muy pocas de ellas en la lámina como para hacer un diagnóstico con certeza. Si se encuentra ASAP, hay una alta probabilidad de que también haya cáncer en la próstata, razón por la cual muchos médicos recomiendan repetir la biopsia pocos meses después.
Atrofia inflamatoria proliferativa:
En la atrofia inflamatoria proliferativa (proliferative inflammatory atrophy, PIA), las células de la próstata lucen más pequeñas de lo normal, y hay signos de inflamación en el área. La PIA no es cáncer, pero los investigadores creen que algunas veces puede convertirse en una PIN de alto grado o tal vez en cáncer de próstata directamente. Para más información sobre cómo se informan los resultados de una biopsia de la próstata, lea la sección Patología de la próstata en nuestra página en Internet. Estudios por imágenes para detectar propagación del cáncer de próstata Los estudios por imágenes utilizan ondas sonoras, rayos X, campos magnéticos o sustancias radiactivas para obtener imágenes del interior del cuerpo. Si a usted le descubren cáncer de próstata, su médico utilizará los resultados del tacto recta (DRE), el nivel de PSA y la puntuación Gleason de los resultados de la biopsia para determinar la probabilidad de que su cáncer se haya propagado fuera de la próstata.
Esta información se usa para decidir si se necesita algún estudio por imágenes para identificar una posible propagación del cáncer. Los hombres con un resultado de examen digital del recto normal, un nivel de PSA bajo y una puntuación Gleason baja no necesitan otras pruebas, ya que las probabilidades de que el cáncer se haya propagado son muy bajas. Los estudios por imágenes que se usan con más frecuencia para detectar propagación del cáncer de próstata incluyen:
Gammagrafía ósea
Si el cáncer de próstata se propaga a lugares distantes, comúnmente pasa primero a los huesos. Una gammagrafía ósea puede ayudar a mostrar si el cáncer ha alcanzado a los huesos. Para este estudio, se inyecta una pequeña cantidad de material de baja radiactividad que se asienta en áreas de huesos afectadas por todo el cuerpo. Una cámara especial detecta la radiactividad y crea una imagen del esqueleto. Una gammagrafía ósea puede sugerir cáncer en los huesos, pero para realizar un diagnóstico preciso puede que sea necesario realizar otros estudios, como radiografías regulares, tomografías computarizadas (CT), imágenes por resonancia magnética (MRI), o incluso una biopsia de hueso.
Tomografía computarizada
Una tomografía computarizada (computed tomography, CT) usa rayos X para producir imágenes transversales detalladas de su cuerpo. Este estudio no se emplea con frecuencia en cánceres de próstata recientemente diagnosticados si es muy probable que estén confinados a la próstata de acuerdo con otros hallazgos (tacto rectal, el nivel de PSA y la puntuación Gleason). Aun así, este estudio a veces puede ayudar a determinar si el cáncer de próstata se propagó a los ganglios linfáticos adyacentes. Si el cáncer de próstata regresó después del tratamiento, la tomografía computarizada puede con frecuencia indicar si está creciendo en el interior de otros órganos o en las estructuras de la pelvis. Las tomografías computarizadas no son tan útiles como las imágenes por resonancia magnética (MRI) para observar la glándula prostática.
Imágenes por resonancia magnética
Al igual que la CT, las imágenes por resonancia magnética (magnetic resonance imaging, MRI) muestran imágenes detalladas de los tejidos blandos del cuerpo. Sin embargo, las MRI utilizan ondas de radio e imanes potentes en lugar de rayos X. Para mostrar mejor los detalles, es posible que un material de contraste, llamado gadolinio, se inyecte en una vena antes de realizar el estudio. Las MRI pueden producir una imagen muy clara de la próstata e indicar si el cáncer se ha propagado fuera de la próstata hasta las vesículas seminales o a otras estructuras adyacentes. Esta información puede ser muy importante para determinar las opciones de tratamiento. Sin embargo, al igual que las tomografías, la MRI usualmente no se necesita para los cánceres de próstata recientemente diagnosticados que, según lo determinado por otros factores, probablemente estén confinados en la próstata. Para mejorar la precisión de la MRI, es posible que le coloquen una sonda, llamada espiral endorrectal, en el interior del recto para realizar el estudio. Esto puede causar molestias. Si es necesario, y antes de realizar el estudio, se le puede administrar un medicamento (calmante) para provocar el sueño. Biopsia de los ganglios linfáticos En una biopsia de ganglio linfático, también conocida como disección de ganglios linfáticos o linfadenectomía, se extirpa uno o más ganglios linfáticos para saber si contienen células cancerosas. Este procedimiento no se emplea con mucha frecuencia para el cáncer de próstata, aunque se puede usar para determinar si el cáncer se ha propagado de la próstata a los ganglios linfáticos cercanos.
Biopsia durante la cirugía para tratar el cáncer de próstata
El cirujano puede extirpar los ganglios linfáticos en la pelvis durante la misma operación que se realiza para extirpar la próstata, conocida como prostatectomía radical (lea Cirugía para el cáncer de próstata).
Si existiera más que una muy pequeña probabilidad de que el cáncer se haya propagado (según factores como un alto nivel del PSA o una alta puntuación Gleason), el cirujano puede extirpar algunos ganglios antes de extraer la glándula prostática. En ocasiones, los ganglios se examinarán inmediatamente, mientras usted sigue anestesiado, para ayudar al cirujano a decidir si debe continuar con la prostatectomía radical. Esto se denomina biopsia por congelación, debido a que la muestra de tejido se congela antes de preparar algunas secciones delgadas del tejido que se analizan con un microscopio. Si los ganglios contienen células cancerosas, es posible que se suspenda la operación y no se extirpe la próstata. Esto puede ocurrir si el cirujano cree que es poco probable que la extirpación de la próstata cure el cáncer, y más bien probablemente podría tener como resultado complicaciones o efectos secundarios graves. Por lo general, no se realiza una biopsia por congelación (especialmente si la probabilidad de propagación del cáncer es baja). En lugar de esto, se extraen los ganglios linfáticos y la próstata para ser examinados en un laboratorio. Los resultados de laboratorio usualmente están disponibles varios días después de la cirugía.
La biopsia de ganglios linfáticos como un procedimiento separado
La biopsia de ganglios linfáticos no se realiza con frecuencia como un procedimiento aparte. En ocasiones se usa cuando no se planea realizar una prostatectomía radical (como en los casos de algunos hombres que escogen tratamiento con radioterapia), pero aún es importante saber si los ganglios linfáticos contienen cáncer.
Biopsia laparoscópica: un laparoscopio es un tubo largo y flexible con una pequeña cámara de vídeo en el extremo que se inserta en el abdomen a través de un pequeño corte. Este instrumento le permite al cirujano observar el interior del abdomen y la pelvis sin necesidad de hacer una incisión grande. Se realizan otras incisiones pequeñas para insertar instrumentos largos a fin de extirpar los ganglios linfáticos circundantes a la glándula prostática, los cuales se envían al laboratorio. Gracias a que no es necesario hacer incisiones grandes, la mayoría de las personas se recuperan completamente en sólo uno o dos días, y la operación deja cicatrices muy pequeñas.
Aspiración con aguja fina: si sus ganglios linfáticos parecen agrandados en el estudio por imagen (tal como CT o MRI), un doctor puede tomar una muestra de las células de un ganglio linfático agrandado usando una técnica que se llama aspiración con aguja fina (fine needle aspiration, FNA). En este procedimiento, el médico usa una imagen de tomografía computarizada para guiar una aguja larga y hueca a través de la piel en la parte más inferior del abdomen y hacia el interior de un ganglio agrandado. Antes de introducir la aguja, se adormece la piel con anestesia local. Una jeringa conectada a la aguja permite al médico tomar una pequeña muestra de tejido del ganglio, el cual se envía entonces al laboratorio para saber si se observan células cancerosas. Usted podrá regresar a su casa unas horas después del procedimiento.
La etapa o estadio (extensión) de un cáncer de próstata es uno de los factores más importantes que se toma en cuenta para evaluar las opciones de tratamiento y para predecir la expectativa de supervivencia (pronóstico) de un hombre. La etapa se basa en lo siguiente:
- Los resultados de la biopsia de la próstata (incluyendo la puntación Gleason)
- El nivel de PSA en la sangre al momento de realizar el diagnóstico
- Los resultados de otros exámenes o pruebas que se hicieron para saber hasta qué punto se ha propagado el cáncer.
Estas pruebas se describen en “Pruebas para detectar el cáncer de próstata”.
El sistema TNM de estatificación (clasificación por etapas) del AJCC
Los sistemas de estatificación son usados por los especialistas del cáncer para describir de forma estándar cuán lejos se ha propagado el cáncer. El sistema de estatificación más usado para el cáncer de próstata es el sistema TNM del American Joint Committee on Cancer (AJCC). El sistema TNM para el cáncer de próstata se basa en cinco piezas clave de información:
- La extensión del tumor principal (categoría T)
- Si el cáncer se propagó a los ganglios linfáticos (nódulos) cercanos (categoría N)
- Si el cáncer se ha propagado (hecho metástasis) a otras partes del cuerpo (categoría M)
- El nivel de PSA al momento de realizar el diagnóstico
- La puntación Gleason, según la biopsia de la próstata (o cirugía)
Hay dos tipos de clasificación por etapa para el cáncer de próstata:
- La etapa clínica es un estimado de la extensión de su enfermedad que realiza el médico basado en los resultados del examen físico (incluyendo el tacto rectal), los análisis de laboratorio, la biopsia de la próstata, y cualquier estudio por imágenes que haya tenido.
- Si se sometió a una cirugía, sus médicos también pueden determinar la etapa patológica que se basa en los resultados anteriores y los resultados de la cirugía. Esto significa que si usted se sometió a una cirugía, la etapa de su cáncer podría cambiar después de la operación (por ejemplo, si se encontró cáncer en un lugar donde no se sospechaba que estaba la enfermedad). La clasificación patológica por etapas probablemente sea más precisa que la clasificación clínica, ya que le da a su médico una impresión directa de la extensión de su enfermedad.
Ambos tipos de clasificación usan las mismas categorías (pero la categoría T1 solo se utiliza en la etapa clínica).
Categorías T (clínicas)
Se utilizan cuatro categorías para describir la extensión local del tumor de la próstata, desde T1 hasta T4. La mayoría de éstas también tienen subcategorías.
T1: su médico no puede palpar el tumor ni verlo con estudios por imágenes, como por ejemplo con una ecografía transrectal.
- T1a: el cáncer se descubre por casualidad (accidentalmente) durante la resección transuretral de la próstata (TURP) que se hizo para el tratamiento de la hiperplasia prostática benigna (un crecimiento no canceroso de la próstata). El cáncer no se encuentra en más del 5% del tejido extirpado.
- T1b: el cáncer se detecta durante la TURP, pero está presente en más de un 5% del tejido extirpado.
- T1c: el cáncer se encuentra mediante una biopsia por aguja, realizada debido a un nivel aumentado de PSA.
T2: su médico puede palpar el cáncer cuando realiza un tacto rectal (DRE) o lo observa mediante un estudio por imágenes, como ecografía transrectal, pero parece que aún está limitado a la próstata.
- T2a: el cáncer se encuentra en la mitad o menos de un solo lado (izquierdo o derecho) de la próstata.
- T2b: el cáncer se encuentra en más de la mitad de un solo lado (izquierdo o derecho) de la próstata.
- T2c: el cáncer está en ambos lados de la próstata.
T3: el cáncer se extendió fuera de la próstata y pudo haberse propagado a las vesículas seminales.
- T3a: el cáncer se extendió fuera de la próstata, pero no afectó a las vesículas seminales.
- T3b: el cáncer se propagó hacia las vesículas seminales.
T4: el cáncer ha crecido hacia los tejidos adyacentes a la próstata (además de las vesículas seminales), como por ejemplo al esfínter uretral (un músculo que ayuda a controlar la micción), al recto, a la vejiga, y/o a la pared de la pelvis.
Categorías N
Las categorías N describen si el cáncer se ha propagado a los ganglios (nódulos) linfáticos cercanos (regionales).
NX: los ganglios linfáticos adyacentes no fueron evaluados.
N0: el cáncer no se ha propagado a ningún ganglio linfático adyacente.
N1: el cáncer se ha propagado a uno o más ganglios linfáticos cercanos.
Categorías M
Las categorías M describen si el cáncer se ha propagado a partes distantes del cuerpo. Los huesos y los ganglios linfáticos distantes son los lugares más comunes a donde el cáncer de próstata se propaga, aunque también se puede propagar a otros órganos, como a los pulmones y al hígado.
M0: el cáncer no se ha propagado más allá de los ganglios linfáticos cercanos.
M1: el cáncer se propagó más allá de los ganglios linfáticos cercanos.
- M1a: el cáncer se propagó a los ganglios linfáticos distantes (en el exterior de la pelvis).
- M1b: el cáncer se propagó a los huesos.
- M1c: el cáncer se propagó a otros órganos tales como los pulmones, el hígado o el cerebro (con propagación a los huesos o sin ella).
Agrupamiento de las categorías para establecer las etapas
Una vez que se han determinado las categorías T, N y M, esta información se combina (junto con la puntuación Gleason y el PSA, si están disponibles), para obtener la etapa general del cáncer. La etapa se expresa en números romanos desde I (la etapa menos avanzada) hasta IV (la etapa más avanzada). La etapa ayuda a determinar las opciones de tratamiento y la expectativa de supervivencia (pronóstico) de un hombre.
LOS POLIFENOLES

Los polifenoles son agentes reductores, de origen vegetal, que junto con otros compuestos antioxidantes de la dieta, tales como vitamina C, vitamina E y carotenoides, protegen a los tejidos corporales frente al estrés oxidativo. Son los agentes antioxidantes que con mayor frecuencia se consumen en la dieta. Normalmente, pueden prevenir diversas enfermedades relacionadas con el estrés oxidativo, como por ejemplo el cáncer, las enfermedades cardiovasculares, la inflamación, etc.
La estructura química del polifenol afectará a sus propiedades biológicas, principalmente su biodisponibilidad, capacidad antioxidante y la interacción específica con receptores celulares y enzimas.
La clasificación principal de los polifenoles es definida de acuerdo a la naturaleza de su esqueleto carbonado: ácidos fenólicos, flavonoides y también, aunque menos comunes, los estilbanos y los lignanos. Los ácidos fenólicos se encuentran abundantemente en los alimentos, especialmente el ácido cafeico y, en menor medida, el ácido ferúlico.
Los flavonoides, los polifenoles más abundantes en la dieta, pueden dividirse en varios tipos según el grado de oxidación del oxígeno heterocíclico, como por ejemplo las flavonas, los flavonoles, las isoflavonas, las antocianinas, etc. La fuente principal de isoflavonas es la soya, que contiene genisteína y daidzeína, que por sus propiedades estrogénicas, pueden desempeñar un papel relevante en la prevención en el cáncer de mama.
Conociendo los factores predisponentes, se puede actuar sobre algunos de ellos para disminuir el riesgo de prevalencia de esta enfermedad.
Numerosos estudios han demostrado la actividad quimiopreventiva frente al cáncer por parte de los Polifenoles del Té Verde, de la Cúrcuma, del Brocoli o de la Granada por citar algunos ejemplos, donde se ha observado la capacidad de bloquear la carcinogénesis (proceso por el cual una célula normal se convierte en una célula cancerosa) y de inhibir el crecimiento de tumores en animales o en cultivos celulares (estudios in vitro e in vivo). Estos efectos se pueden atribuir a mecanismos bioquímicos en células cancerígenas como:
– La apoptosis (muerte celular)
– La detención del crecimiento en una o más fases en el ciclo celular
– La inhibición de la síntesis de ADN
– La modulación de las vías de transducción de señales por la expresión alterada de enzimas (como las ciclooxigenasas y quinasas)
– La reducción de daño oxidativo
Como ya vimos en la descripción de generalidades del cáncer, éste tiene varias etapas:
- Iniciación
- Promoción
- y posiblemente también la etapa de Progresión, donde pueden actuar los POLIFENOLES sobre los mecanismos descritos anteriormente.
Las principales investigaciones en ratones con distintos tipos de cáncer (in vivo) o diferentes líneas de células tumorales (in vitro), han concluido que Los POLIFENOLES tienen un papel más importante en la prevención y progresión de algunos tipos de cánceres como bucales, cáncer de próstata, cáncer de mama, cáncer de colon, cáncer de pulmón, cáncer de piel, teratocarcinoma y osteosarcoma.
Los polifenoles (PF), unas potentes moléculas antioxidantes que contiene el té verde, provocan la detención del ciclo celular y activan muerte programada de las células del cáncer de próstata. Una reciente investigación, publicada en la revista Carcinogenesis y dirigida por el Dr. VS Thakur del Departamento de Urología de la Case Western Reserve University, en Cleveland, Ohio (USA), ha desentrañado los mecanismos que subyacen en la acción antiproliferativa de los PF. Las células de cáncer de próstata, “in vitro” fueron tratadas con 10-80mg /ml de PF durante 24 horas, observando una detención del ciclo celular G0-G1 y una inducción de la apoptosis (muerte celular programada). Los investigadores demostraron que los efectos antiproliferativos se deben a la inhibición de un enzima, la histona deacetilasa (HDAC). Estos hallazgos servirán para desarrollar estrategias de prevención y Carcinogenesis (2012) 33 (2): 377-384.
INVESTIGACIÓN DIRIGIDA POR: Facultad de Farmacia de la Universidad Médica de Xinjiang, China; El Primer Hospital Docente de la Universidad Médica de Xinjiang, China; Laboratorio de Recursos de Investigación de Plantas y Desarrollo, Beijing Tecnología y Negocios de la Universidad de China.
PUBLICADA EN: Food Science and Biotechnology AÑO: 2015
PAÍSES: China
RESUMEN DE LA INVESTIGACIÓN:
La granada posee fuertes propiedades antitumorales. En este estudio, se estableció un modelo de ratón desnudo con un xeno-injerto subcutáneo de las células de cáncer de próstata humano (PC-3) para observar el efecto antiproliferativo in vivo y apoptóticos de los polifenoles de la cáscara de granada. Los niveles de factor de necrosis tumoral α citocinas (TNF-α) y factor de crecimiento endotelial vascular (VEGF) se detectaron mediante ensayo de inmunoabsorción ligado a enzimas. Se realizó un análisis cuantitativo de ácido elágico, ácido gálico y punicalagina en la fracción activa mediante cromatografía líquida de alta resolución en fase inversa con una matriz de fotodiodos (HPLC / PDA). Los polifenoles de la cáscara de la granada disminuyeron el volumen y el peso del tumor en ratones portadores de tumores y aumentó significativamente la tasa de apoptosis (p <0,05). Además, los polifenoles de la granada aumentaron cáscara TNF-α y la disminución de VEGF en el suero (p <0,05). El ácido elágico (201,3 ± 3,544 mg / g), ácido gálico (8,917 ± 0,274 mg / g), y punicalagina (407,0 ± 12,05 mg / g) fueron los principales efectores de la actividad anti-tumor.
Otro importante estudio fue piublicado en la Revista Nature www.nature.com/pcan
Prostat cancer and Prostaic disease (2014) 1-7 (2014 Macmillan PublishersLimited All rights reserved 1365-7852/14)
Éste estudio es llamado:
ORIGINAL ARTICLE
A doublé-blind, placebo-controlled randomised trial avaluating the effect of a polyphenol-rich whole food supplement on PSA progression in men with prostate cancer-the UK NCRN Pomi-T study.
[Articulo Original, Estudio Clínico controlado con placebo, doble ciego y randomisado para evaluar el efecto de los polifenoles ricos en los suplementos alimenticios sobre el PSA (antígeno prostático específico por sus siglas en Inglés)en hombres con cáncer de próstata. Un estudio realizado en Londres a un Producto llamado Pomi-T].
Como se ha podido observar estos compuestos químicos llamados Polifenoles y que se encuentran de manera natural en algunos alimentos, se ha demostrado que ayudan en la prevención y durante el establecimiento del cáncer de próstata, pero el gran reto es consumir las cantidades adecuadas en la dieta, lo cual se antoja casi imposible… por ello se han desarrollado estos productos que los proveen y que son de origen natural y no conflictuan con ningún tratamiento médico o con la ingesta de la dieta diaria de una persona, lo que si es importante destacar es que cualquier producto que vayamos a consumir deberíamos evaluar varios parámetros, no sólo el costo del producto, sino por ejemplo:
- ¿Quién lo Fabrica? (es una Laboratorio Farmacéutico de Prestigio?)
- ¿Está Estandarizado el Producto? (es decir, me pueden garantizar que siempre voy a tomar las mismas cantidades?)
- ¿Es Grado Farmacéutico? (es decir, la cantidad o concentración que voy a tomar del polifenol de origen natural es puro?; ¿La cantidad o concentración a tomar es la que necesito para lograr el efecto benéfico?
Si podemos contestar positivamente estos 3 puntos arriba descritos el producto es el indicado…
Finalmente… Lo mas Importante siempre va a ser la Decisión de Tú Médico de si debes tomar o no? cualquier producto, por lo que te recomedamos Consultar a tu Médico y tener una charla y tratamiento para el beneficio de tu Salud!
Las pruebas de detección tienen el objetivo de descubrir cáncer antes de que se presente algún síntoma. Para algunos tipos de cáncer, las pruebas de detección pueden ayudar a encontrar cánceres en una etapa inicial cuando probablemente sean más fáciles de tratar. Frecuentemente se puede encontrar el cáncer de próstata antes de que surjan síntomas mediante el análisis de la cantidad de antígeno prostático específico (prostate-specific antigen, PSA) en la sangre de un hombre. El cáncer de próstata también se puede encontrar durante un examen digital del recto o tacto rectal (digital rectal exam, DRE). En este examen, el médico se coloca un guante lubricado para insertar un dedo en el recto y palpar la glándula prostática. Estas pruebas se describen detalladamente en Prevención y detección temprana del cáncer de próstata. Si los resultados de una de estas pruebas son anormales, se realizan pruebas adicionales para saber si un hombre tiene cáncer. Si se encuentra cáncer de próstata mediante las pruebas de detección PSA o DRE, probablemente el cáncer se encontrará en una etapa más temprana y más tratable que la etapa de un cáncer que no hubiese sido detectado precozmente con estas pruebas.
Las pruebas de detección definitivamente pueden ayudar a encontrar muchos cánceres de próstata en etapa temprana, pero aún no está claro si los beneficios de las pruebas superan a los riesgos en la mayoría de los hombres. Hoy día, las pruebas de detección que se utilizan para el cáncer de próstata presentan claramente tanto beneficios como desventajas.
Actualmente, la Sociedad Americana Contra El Cáncer recomienda que los hombres que estén considerando las pruebas de detección del cáncer de próstata deben tomar decisiones fundadas en la información disponible, el diálogo con sus médicos y sus opiniones sobre los posibles beneficios, riesgos y limitaciones de las pruebas de detección. Para más información sobre las guías de detección para el cáncer de próstata de la Sociedad Americana Contra El Cáncer, lea Prevención y detección temprana del cáncer de próstata.
Por lo general, el cáncer de próstata en etapa inicial no causa síntomas. Los cánceres de próstata más avanzados a veces causan síntomas, como:
• Problemas al orinar, incluyendo un flujo urinario lento o debilitado o necesidad de
orinar con más frecuencia, especialmente de noche
• Sangre en la orina o el semen
• Dificultad para lograr una erección (disfunción eréctil)
• Dolor en las caderas, la espalda (columna vertebral), el tórax (costillas) u otras áreas
debido a que el cáncer que se ha propagado a los huesos
• Debilidad o adormecimiento de las piernas o los pies, o incluso pérdida del control de la vejiga o los intestinos debido a que el cáncer comprime la médula espinal.
Es más probable que la mayoría de estos problemas sean por causa distinta al cáncer de próstata. Por ejemplo, la hiperplasia prostática benigna (un crecimiento no canceroso de la próstata) causa dificultad para orinar con mucha más frecuencia que el cáncer. Aun así, resulta importante que usted le informe a su médico si presenta cualquiera de estos síntomas para que la causa se encuentre y se trate, de ser necesario.
La mayoría de los cánceres de próstata se detecta primero mediante la prueba sanguínea del antígeno prostático específico (prostate-specific antigen, PSA) o el tacto rectal (digital rectal exam, DRE). (Lea Prevención y detección temprana del cáncer de próstata). Por lo general, los cánceres de próstata en etapas iniciales no causan síntomas, en cambio los cánceres más avanzados se pueden detectar debido a los síntomas que causan. Si se sospecha cáncer basándose en los resultados de las pruebas de detección o en los síntomas, será necesario realizar pruebas para confirmar el diagnóstico. El diagnóstico definitivo de cáncer de próstata se puede llevar a cabo únicamente mediante una biopsia de la próstata.
Si su médico sospecha que usted tiene cáncer de próstata, él o ella le preguntará si presenta síntomas, tales como problemas urinarios o sexuales, y el tiempo que los lleva presentando. Puede que también le pregunte acerca de posibles factores de riesgo, incluyendo sus antecedentes familiares. Además, su doctor realizará una revisión médica que puede incluir un tacto rectal (digital rectal exam o DRE, en inglés). Para este examen, el doctor introducirá en el recto un dedo cubierto con un guante lubricado a fin de palpar cualquier abultamiento o área firme en la próstata que pueda ser cáncer. Si usted tiene cáncer, algunas veces el DRE puede ayudar a indicar si el cáncer se encuentra en un solo lado de la próstata, o en ambos lados, o si hay probabilidades de que se haya propagado de la glándula prostática a los tejidos cercanos.
Su médico también puede examinar otras áreas de su cuerpo, y puede ordenar algunas pruebas.
La prueba de sangre del antígeno prostático específico (PSA) se usa principalmente para detectar el cáncer de próstata en los hombres que no presentan síntomas (lea Prevención y detección temprana del cáncer de próstata). También es una de las primeras pruebas realizadas en los hombres que presentan síntomas que podrían ser causados por cáncer de próstata.
La mayoría de los hombres sin cáncer de próstata tiene niveles de PSA menores a 4 nanogramos (ng/mL) por mililitro de sangre. La probabilidad de tener cáncer de próstata aumenta a medida que el nivel de PSA sube.
Cuando se forma el cáncer de próstata, el nivel de PSA generalmente aumenta a más de 4 nanogramos. Sin embargo, un nivel por debajo de 4 no garantiza que un hombre no tenga cáncer. Alrededor del 15% de los hombres que tienen un PSA menor de 4 presentarácáncer de próstata en una biopsia.
Los hombres que tienen un nivel de PSA de 4 a 10 tienen una probabilidad de 1 en 4 de padecer cáncer de próstata. Si el PSA es mayor de 10, la probabilidad de tener cáncer de próstata es de más de 50%.
No todos los médicos usan el mismo valor límite de PSA para decidir cuándo se debe hacer una biopsia de la próstata. Si el PSA es de 4 o más, algunos médicos pueden recomendar la biopsia, mientras que otros pueden recomendarla comenzando a un nivel más bajo, como 2.5 o 3. También otros factores pueden afectar esta decisión, tales como la edad, la raza, y el antecedente familiar.
La prueba de PSA también puede ser útil si usted ya recibió un diagnóstico de cáncer de próstata.
• En los hombres que acaban de ser diagnosticados con cáncer de próstata, la prueba el PSA se puede usar junto con los resultados del examen físico y el grado tumoral (determinado en la biopsia, descrito más adelante) para ayudar a decidir si se requieren otras pruebas (tal como tomografía computarizada o gammagrafías óseas).
• La prueba de PSA es parte de la estadificación o estadiaje (el proceso de determinar la etapa del cáncer) y puede ayudar a indicar si es probable que su cáncer siga limitado a la próstata. Si su nivel de PSA es muy alto, es más probable que su cáncer se haya propagado fuera de la próstata. Esto podría afectar sus opciones de
tratamiento, ya que es probable que algunas formas de tratamiento (como la cirugía y la radiación) no sean útiles si el cáncer se ha propagado a los ganglios linfáticos, a los huesos o a otros órganos.
• Las pruebas de PSA también son una parte importante en la evaluación del cáncer de próstata durante y después del tratamiento (lea Seguimiento de los niveles de PSA durante y después del tratamiento.
Para realizar la ecografía transrectal (transrectal ultrasound, TRUS), se lubrica y coloca una pequeña sonda de aproximadamente el ancho de un dedo en su recto. Esta sonda libera ondas de sonido que entran en la próstata y crean ecos. La sonda detecta los ecos y una computadora entonces las convierte en una imagen en blanco y negro de la próstata. A menudo, el procedimiento sólo dura unos 10 minutos y se puede realizar en el consultorio del médico o en una clínica ambulatoria. Usted sentirá algo de presión durante la introducción de la sonda, pero usualmente este procedimiento no causa dolor. Se puede adormecer el área antes de realizar el procedimiento. La TRUS a menudo se usa para examinar la próstata cuando un hombre presenta un alto nivel de PSA o un resultado de DRE anormal. También se usa durante una biopsia de la próstata para guiar las agujas al área correcta de la próstata. La TRUS también es útil en otras situaciones. Se puede emplear para medir el tamaño de la glándula prostática, lo que puede ayudar a determinar la densidad del PSA (descrito en Prevención y detección temprana del cáncer de próstata) y también puede influir en las opciones de tratamiento del paciente. Además, la TRUS se usa como una guía durante algunas formas de tratamiento, tal como braquiterapia (radioterapia interna) o crioterapia.
Si ciertos síntomas o los resultados de las pruebas, como la prueba de sangre PSA o el examen digital del recto, sugieren que usted puede tener cáncer de próstata, su médico hará una biopsia de la próstata. Una biopsia es un procedimiento para extraer pequeñas muestras de la próstata y luego examinarlas al microscopio. Una biopsia por punción con aguja gruesa es el principal método usado para diagnosticar el cáncer de próstata. Por lo general, un urólogo realiza la biopsia, quien es un cirujano que trata los cánceres del tracto genitourinario, incluyendo la glándula prostática. El médico emplea la TRUS para “observar” la glándula prostática e insertar rápidamente una aguja delgada y hueca a través de la pared del recto hasta alcanzar la próstata. Al retirar la aguja, se extrae un pequeño cilindro de tejido prostático. Esto se repite varias veces. La mayoría de los urólogos tomará alrededor de 12 muestras cilíndricas de diferentes partes de la próstata. Aunque el procedimiento parece doloroso, por lo general cada biopsia solo causa una sensación desagradable breve debido a que se hace con un instrumento especial de biopsia con resorte automático. Este dispositivo introduce y retira la aguja en fracciones de segundo. La mayoría de los médicos que realiza la biopsia adormecerán el área primero al inyectar un anestésico local al lado de la próstata. Sería bueno que le pregunte a su médico si él o ella planea hacer esto.
La biopsia por sí sola dura aproximadamente 10 minutos y por lo general se realiza en el consultorio del médico. Es probable que se le administren antibióticos antes de la biopsia, y posiblemente por un día o dos después del procedimiento para reducir el riesgo de infección. Unos pocos días después del procedimiento, usted puede sentir cierta molestia en el área y puede notar sangre en su orina. Además puede sangrar un poco por el recto, especialmente si tiene hemorroides. Muchos hombres observan sangre en el semen o semen de color del metal oxidado, lo que puede durar por algunas semanas después de la biopsia (dependiendo de cuán frecuentemente eyacule). Las muestras obtenidas por medio de la biopsia se enviarán a un laboratorio para observarse con un microscopio y ver si contiene células cancerosas. Si se observa cáncer, también se le asignará un grado (vea la próxima sección). Usualmente los resultados (presentados en un informe de patología) están disponibles de uno a tres días, aunque a veces podría tomar más tiempo.
Aun cuando se toman muchas muestras, las biopsias pueden algunas veces pasar por alto el cáncer si ninguna de las agujas de la biopsia lo alcanza. Esto se conoce como resultado negativo falso. Si su médico sigue teniendo mucha sospecha de que usted tiene cáncer de próstata (por ejemplo, debido a que su PSA está muy elevado), es posible que sea necesario repetir la biopsia para ayudar a confirmar si hay o no cáncer.
Grado (puntación Gleason) del cáncer de próstata
A los cánceres de próstata se les asigna un grado según el sistema de Gleason. Este sistema asigna un grado Gleason basándose en cuánto se parece el cáncer al tejido normal de la próstata.
• Si el cáncer se parece mucho al tejido prostático normal, se le asigna un grado 1.
• Si el cáncer luce muy anormal, se le asigna un grado 5.
• Los grados 2 al 4 tienen características entre estos extremos.
La mayoría de los cánceres son grado 3 o más, y los grados 1 y 2 no se usan con frecuencia. Debido a que los cánceres de próstata a menudo tienen áreas con diferentes grados, se asigna un grado a las dos áreas que forman la mayor parte del cáncer. Estos dos grados se suman para obtener una puntación Gleason (también llamada “escala de Gleason”). Existen algunas excepciones a esta regla. Si el grado más alto compone la mayoría de la muestra de la biopsia (95% o más), el grado para esa área se cuenta doble en la puntuación Gleason. Además, si hay 3 grados en una biopsia por punción, el grado más alto siempre se incluye en la puntuación Gleason, incluso si la mayor parte de la muestra cilíndrica de tejido está compuesta por áreas de cáncer con grados menores. La puntuación Gleason puede ser entre 2 y 10, aunque en la mayoría de las biopsias es de al menos un 6. Cuánto más alto sea la puntuación Gleason, más probable es que su cáncer crezca y se propague rápidamente. Además de la puntuación Gleason, a veces se usan otros términos para indicar el grado del cáncer:
• A los cánceres con puntuación Gleason de 6 o menos, se les puede llamar cánceres bien diferenciados o de bajo grado.
• A los cánceres con puntuación Gleason 7 se les llama cánceres moderadamente diferenciados o de grado intermedio.
• A los cánceres con puntuación Gleason de 8 a 10 se les llama cánceres pobremente diferenciados o de alto grado.
Junto con el grado del cáncer (si está presente), el informe de patología a menudo contiene otra información sobre el cáncer, como:
• El número de muestras de biopsia por punción que contiene cáncer (por ejemplo, “7 de 12”).
• El porcentaje de cáncer en cada una de las muestras.
• Si el cáncer está en un lado (izquierdo o derecho) de la próstata o en ambos lados (bilateral).
Algunas veces, cuando se observan las células prostáticas, éstas no parecen ser cáncer, pero tampoco se ven normales. A menudo, estos resultados se catalogan como sospechosos.
Neoplasia prostática intraepitelial: en la neoplasia prostática intraepitelial (prostatic intrepithelial neoplasia, PIN), hay cambios en la apariencia de las células de la glándula prostática, pero las células anormales no parecen estar invadiendo otras partes de la próstata (como sí lo harían las células cancerosas). La PIN a menudo se divide en dos grupos:
• PIN de bajo grado: los patrones de las células de la próstata se ven casi normales.
• PIN de alto grado: los patrones de las células se ven más anormales.
Muchos hombres comienzan a presentar una neoplasia de bajo grado a una edad temprana, pero no necesariamente padecerán cáncer. Aún no está clara la importancia de la neoplasia prostática intraepitelial de bajo grado con respecto al cáncer de próstata. Si en una biopsia de la próstata se reporta un hallazgo de PIN de bajo grado, el seguimiento para los pacientes usualmente es el mismo al que se daría si nada anormal se hubiese reportado. Si en la biopsia se encuentra una neoplasia prostática intraepitelial de alto grado, hay una probabilidad aproximada de 20% de que el cáncer ya esté presente en algún lugar de la próstata. Por esta razón, los médicos a menudo observan cuidadosamente a los hombres con neoplasia prostática intraepitelial de alto grado y pueden recomendar la repetición de una biopsia de la próstata, especialmente si la biopsia original no tomó muestras de todas las partes de la glándula.
Proliferación microacinar atípica:
Algunas veces simplemente se denomina como atipia. En la proliferación microacinar atípica (atypical small acinar proliferation, ASAP), las células parecen ser cancerosas cuando se observan con un microscopio, pero hay muy pocas de ellas en la lámina como para hacer un diagnóstico con certeza. Si se encuentra ASAP, hay una alta probabilidad de que también haya cáncer en la próstata, razón por la cual muchos médicos recomiendan repetir la biopsia pocos meses después.
estructuras de la pelvis. Las tomografías computarizadas no son tan útiles como las imágenes por resonancia magnética (MRI) para observar la glándula prostática.
Imágenes por resonancia magnética
Al igual que la CT, las imágenes por resonancia magnética (magnetic resonance imaging, MRI) muestran imágenes detalladas de los tejidos blandos del cuerpo. Sin embargo, las MRI utilizan ondas de radio e imanes potentes en lugar de rayos X. Para mostrar mejor los detalles, es posible que un material de contraste, llamado gadolinio, se inyecte en una vena antes de realizar el estudio. Las MRI pueden producir una imagen muy clara de la próstata e indicar si el cáncer se ha propagado fuera de la próstata hasta las vesículas seminales o a otras estructuras adyacentes. Esta información puede ser muy importante para determinar las opciones de tratamiento. Sin embargo, al igual que las tomografías, la MRI usualmente no se necesita para los cánceres de próstata recientemente diagnosticados que, según lo determinado por otros factores, probablemente estén confinados en la próstata. Para mejorar la precisión de la MRI, es posible que le coloquen una sonda, llamada espiral endorrectal, en el interior del recto para realizar el estudio. Esto puede causar molestias. Si es necesario, y antes de realizar el estudio, se le puede administrar un medicamento (calmante) para provocar el sueño. Biopsia de los ganglios linfáticos En una biopsia de ganglio linfático, también conocida como disección de ganglios linfáticos o linfadenectomía, se extirpa uno o más ganglios linfáticos para saber si contienen células cancerosas. Este procedimiento no se emplea con mucha frecuencia para el cáncer de próstata, aunque se puede usar para determinar si el cáncer se ha propagado de la próstata a los ganglios linfáticos cercanos.
El cirujano puede extirpar los ganglios linfáticos en la pelvis durante la misma operación que se realiza para extirpar la próstata, conocida como prostatectomía radical (lea Cirugía para el cáncer de próstata).
Si existiera más que una muy pequeña probabilidad de que el cáncer se haya propagado (según factores como un alto nivel del PSA o una alta puntuación Gleason), el cirujano puede extirpar algunos ganglios antes de extraer la glándula prostática. En ocasiones, los ganglios se examinarán inmediatamente, mientras usted sigue anestesiado, para ayudar al cirujano a decidir si debe continuar con la prostatectomía radical. Esto se denomina biopsia por congelación, debido a que la muestra de tejido se congela antes de preparar algunas secciones delgadas del tejido que se analizan con un microscopio. Si los ganglios contienen células cancerosas, es posible que se suspenda la operación y no se extirpe la próstata. Esto puede ocurrir si el cirujano cree que es poco probable que la extirpación de la próstata cure el cáncer, y más bien probablemente podría tener como resultado complicaciones o efectos secundarios graves. Por lo general, no se realiza una biopsia por congelación (especialmente si la probabilidad de propagación del cáncer es baja). En lugar de esto, se extraen los ganglios linfáticos y la próstata para ser examinados en un laboratorio. Los resultados de laboratorio usualmente están disponibles varios días después de la cirugía.
La biopsia de ganglios linfáticos no se realiza con frecuencia como un procedimiento aparte. En ocasiones se usa cuando no se planea realizar una prostatectomía radical (como en los casos de algunos hombres que escogen tratamiento con radioterapia), pero aún es importante saber si los ganglios linfáticos contienen cáncer.
Biopsia laparoscópica: un laparoscopio es un tubo largo y flexible con una pequeña cámara de vídeo en el extremo que se inserta en el abdomen a través de un pequeño corte. Este instrumento le permite al cirujano observar el interior del abdomen y la pelvis sin necesidad de hacer una incisión grande. Se realizan otras incisiones pequeñas para insertar instrumentos largos a fin de extirpar los ganglios linfáticos circundantes a la glándula prostática, los cuales se envían al laboratorio. Gracias a que no es necesario hacer incisiones grandes, la mayoría de las personas se recuperan completamente en sólo uno o dos días, y la operación deja cicatrices muy pequeñas.
Aspiración con aguja fina: si sus ganglios linfáticos parecen agrandados en el estudio por imagen (tal como CT o MRI), un doctor puede tomar una muestra de las células de un ganglio linfático agrandado usando una técnica que se llama aspiración con aguja fina (fine needle aspiration, FNA). En este procedimiento, el médico usa una imagen de tomografía computarizada para guiar una aguja larga y hueca a través de la piel en la parte más inferior del abdomen y hacia el interior de un ganglio agrandado. Antes de introducir la aguja, se adormece la piel con anestesia local. Una jeringa conectada a la aguja permite al médico tomar una pequeña muestra de tejido del ganglio, el cual se envía entonces al laboratorio para saber si se observan células cancerosas. Usted podrá regresar a su casa unas horas después del procedimiento.
La etapa o estadio (extensión) de un cáncer de próstata es uno de los factores más importantes que se toma en cuenta para evaluar las opciones de tratamiento y para predecir la expectativa de supervivencia (pronóstico) de un hombre. La etapa se basa en lo siguiente:
• Los resultados de la biopsia de la próstata (incluyendo la puntación Gleason)
• El nivel de PSA en la sangre al momento de realizar el diagnóstico
• Los resultados de otros exámenes o pruebas que se hicieron para saber hasta qué punto se ha propagado el cáncer.
Estas pruebas se describen en “Pruebas para detectar el cáncer de próstata”.
Los sistemas de estatificación son usados por los especialistas del cáncer para describir de forma estándar cuán lejos se ha propagado el cáncer. El sistema de estatificación más usado para el cáncer de próstata es el sistema TNM del American Joint Committee on Cancer (AJCC). El sistema TNM para el cáncer de próstata se basa en cinco piezas clave de información:
• La extensión del tumor principal (categoría T)
• Si el cáncer se propagó a los ganglios linfáticos (nódulos) cercanos (categoría N)
• Si el cáncer se ha propagado (hecho metástasis) a otras partes del cuerpo (categoría M)
• El nivel de PSA al momento de realizar el diagnóstico
• La puntación Gleason, según la biopsia de la próstata (o cirugía)
Hay dos tipos de clasificación por etapa para el cáncer de próstata:
• La etapa clínica es un estimado de la extensión de su enfermedad que realiza el médico basado en los resultados del examen físico (incluyendo el tacto rectal), los análisis de laboratorio, la biopsia de la próstata, y cualquier estudio por imágenes que haya tenido.
• Si se sometió a una cirugía, sus médicos también pueden determinar la etapa patológica que se basa en los resultados anteriores y los resultados de la cirugía. Esto significa que si usted se sometió a una cirugía, la etapa de su cáncer podría cambiar después de la operación (por ejemplo, si se encontró cáncer en un lugar donde no se sospechaba que estaba la enfermedad). La clasificación patológica por etapas probablemente sea más precisa que la clasificación clínica, ya que le da a su médico una impresión directa de la extensión de su enfermedad.
Ambos tipos de clasificación usan las mismas categorías (pero la categoría T1 solo se utiliza en la etapa clínica).
Se utilizan cuatro categorías para describir la extensión local del tumor de la próstata, desde T1 hasta T4. La mayoría de éstas también tienen subcategorías.
T1: su médico no puede palpar el tumor ni verlo con estudios por imágenes, como por ejemplo con una ecografía transrectal.
• T1a: el cáncer se descubre por casualidad (accidentalmente) durante la resección transuretral de la próstata (TURP) que se hizo para el tratamiento de la hiperplasia prostática benigna (un crecimiento no canceroso de la próstata). El cáncer no se encuentra en más del 5% del tejido extirpado.
• T1b: el cáncer se detecta durante la TURP, pero está presente en más de un 5% del
tejido extirpado.
• T1c: el cáncer se encuentra mediante una biopsia por aguja, realizada debido a un
nivel aumentado de PSA.
T2: su médico puede palpar el cáncer cuando realiza un tacto rectal (DRE) o lo observa mediante un estudio por imágenes, como ecografía transrectal, pero parece que aún está limitado a la próstata.
• T2a: el cáncer se encuentra en la mitad o menos de un solo lado (izquierdo o derecho) de la próstata.
• T2b: el cáncer se encuentra en más de la mitad de un solo lado (izquierdo o derecho) de la próstata.
• T2c: el cáncer está en ambos lados de la próstata.
T3: el cáncer se extendió fuera de la próstata y pudo haberse propagado a las vesículas seminales.
• T3a: el cáncer se extendió fuera de la próstata, pero no afectó a las vesículas seminales.
• T3b: el cáncer se propagó hacia las vesículas seminales.
T4: el cáncer ha crecido hacia los tejidos adyacentes a la próstata (además de las vesículas seminales), como por ejemplo al esfínter uretral (un músculo que ayuda a controlar la micción), al recto, a la vejiga, y/o a la pared de la pelvis.
Las categorías N describen si el cáncer se ha propagado a los ganglios (nódulos) linfáticos cercanos (regionales).
NX: los ganglios linfáticos adyacentes no fueron evaluados.
N0: el cáncer no se ha propagado a ningún ganglio linfático adyacente.
N1: el cáncer se ha propagado a uno o más ganglios linfáticos cercanos.
Las categorías M describen si el cáncer se ha propagado a partes distantes del cuerpo. Los huesos y los ganglios linfáticos distantes son los lugares más comunes a donde el cáncer de próstata se propaga, aunque también se puede propagar a otros órganos, como a los pulmones y al hígado.
M0: el cáncer no se ha propagado más allá de los ganglios linfáticos cercanos.
M1: el cáncer se propagó más allá de los ganglios linfáticos cercanos.
• M1a: el cáncer se propagó a los ganglios linfáticos distantes (en el exterior de la pelvis).
• M1b: el cáncer se propagó a los huesos.
• M1c: el cáncer se propagó a otros órganos tales como los pulmones, el hígado o el cerebro (con propagación a los huesos o sin ella).
Una vez que se han determinado las categorías T, N y M, esta información se combina (junto con la puntuación Gleason y el PSA, si están disponibles), para obtener la etapa general del cáncer. La etapa se expresa en números romanos desde I (la etapa menos avanzada) hasta IV (la etapa más avanzada). La etapa ayuda a determinar las opciones de tratamiento y la expectativa de supervivencia (pronóstico) de un hombre
CAQUEXIA
El término caquexia se deriva de las palabras griegas kakos y hexis, que significan «mal estado». Se cree que Hipócrates reconoció el síndrome, pero hubo que esperar hasta 2006 para empezar a trabajar en una definición formal de la caquexia, que incluye una pérdida de 5% o más del peso corporal durante un período de 12 meses, y una reducción en la fuerza muscular. Clínicamente, sigue siendo poco reconocida por los oncólogos, dice Egidio Del Fabbro, médico de cuidados paliativos e investigador en la Universidad de Virginia Commonwealth, en Richmond. No existen guías estándar para tratarla.
¿Qué es la caquexia por cáncer?
La declaración de consenso internacional sobre la definición y la clasificación de la caquexia por cáncer, publicada en mayo de 2011 en la revista Lancet Oncology, estableció los siguientes criterios para diagnosticar la caquexia en pacientes con cáncer:
• Pérdida de peso de más de 5% en los últimos 6 meses, o
• Un IMC por debajo de 20 y cualquier grado de pérdida de peso por encima de 2%;
• Índice muscular esquelético en las extremidades indicativo de sarcopenia (otro síndrome de consunción) y pérdida de peso de más 2%.
¿Existe ya algún tratamiento para la CAQUEXIA?
Sí, existe un producto para tratar la caquexia. Es muy importante que preguntes a tu Médico tratante sobre un producto altamente especializado para Caquexia ya disponible en México a partir de este año 2017, investigaciones importantes a nivel mundial de la Farmacéutica Suiza, Helsinn han desarrollado exitosamente a través de la Innovación terapéutica un Suplemento de Amino Ácidos Esenciales, y con evidencia clínica de 4 estudios clínicos con caquexia en cáncer. (4 clinical studies in Cancer Caquexia, COPD, KF and CHF and 1 ongoing AMIXEA, study on patients with advanced non-small cell lung cáncer a randomized, doublé blind, placebo-controlled, multicentre, study).
El término caquexia se deriva de las palabras griegas kakos y hexis, que significan «mal estado». Se cree que Hipócrates reconoció el síndrome, pero hubo que esperar hasta 2006 para empezar a trabajar en una definición formal de la caquexia, que incluye una pérdida de 5% o más del peso corporal durante un período de 12 meses, y una reducción en la fuerza muscular. Clínicamente, sigue siendo poco reconocida por los oncólogos, dice Egidio Del Fabbro, médico de cuidados paliativos e investigador en la Universidad de Virginia Commonwealth, en Richmond. No existen guías estándar para tratarla.
En la última década, los investigadores han aprendido más sobre las causas de la caquexia, gracias al financiamiento otorgado por el Instituto Nacional del Cáncer de Estados Unidos y algunos grupos de defensa de la enfermedad. Nuevas conferencias internacionales (incluyendo una que finalizó a principios de mes en París) y el lanzamiento de una revista de investigación —Journal of Cachexia, Sarcopenia and Muscle— también han aumentado el interés en el campo.

La caquexia se observa en las últimas etapas de casi todas las enfermedades crónicas grandes, afectando entre 16% y 42% de las personas con insuficiencia cardíaca, el 30% de los pacientes con enfermedad pulmonar obstructiva crónica y hasta a un 60% de las personas con enfermedad renal. Pero durante muchos años se pasó por alto, dado que médicos e investigadores centraban su atención en la enfermedad principal.
Según algunas estimaciones, casi un tercio de las muertes por cáncer pueden atribuirse a un síndrome de consunción conocido como caquexia, el cual puede ser devastador tanto para los pacientes como para sus familias. Caracterizada por una alarmante pérdida de masa muscular esquelética y a menudo acompañada de una pérdida considerable de peso, la caquexia es una forma de rebelión metabólica en la cual el organismo muy diligentemente descompone los músculos esqueléticos y el tejido adiposo, en el cual se almacena la grasa.
Los pacientes que padecen caquexia a menudo son tan frágiles y se sienten tan débiles que caminar puede convertirse en una tarea hercúlea.
La caquexia se presenta en muchos tipos de cáncer, por lo general en estadios avanzados de la enfermedad.
Es muy frecuente en un subconjunto de tumores malignos, principalmente en el cáncer de páncreas y cáncer gástrico, pero también en el cáncer de pulmón, cáncer de esófago, cáncer de cabeza y cuello y el cáncer colorrectal.
La declaración de consenso internacional sobre la definición y la clasificación de la caquexia por cáncer, publicada en mayo de 2011 en la revista Lancet Oncology, estableció los siguientes criterios para diagnosticar la caquexia en pacientes con cáncer:
• Pérdida de peso de más de 5% en los últimos 6 meses, o
• Un IMC por debajo de 20 y cualquier grado de pérdida de peso por encima de 2%;
• Índice muscular esquelético en las extremidades indicativo de sarcopenia (otro síndrome de consunción) y pérdida de peso de más 2%.
Sí, existe un producto para tratar la caquexia. Es muy importante que preguntes a tu Médico tratante sobre un producto altamente especializado para Caquexia ya disponible en México a partir de este año 2017, investigaciones importantes a nivel mundial de la Farmacéutica Suiza, Helsinn han desarrollado exitosamente a través de la Innovación terapéutica un Suplemento de Amino Ácidos Esenciales, y con evidencia clínica de 4 estudios clínicos con caquexia en cáncer. (4 clinical studies in Cancer Caquexia, COPD, KF and CHF and 1 ongoing AMIXEA, study on patients with advanced non-small cell lung cáncer a randomized, doublé blind, placebo-controlled, multicentre, study).
La declaración de consenso es un buen inicio, según otro coautor, el doctor Mellar Davis del Centro Oncológico Taussing de la Clínica Cleveland. Sin embargo, los investigadores deben profundizar más en la manera como sobreviene la caquexia en pacientes con cáncer, añadió el doctor Davis, y el efecto que tienen en su evolución desde la nutrición y la actividad física hasta factores específicamente característicos de la enfermedad, tales como la reducción de los niveles de tetosterona causada por la terapia oncológica o los opioides administrados para tratar el dolor.
Claramente existen múltiples factores que inciden en la aparición y la evolución de la caquexia, explicó el doctor Goldberg. Él cree que, en su origen, la caquexia es «una respuesta del organismo que ha evolucionado para combatir el ayuno, la lesión o la enfermedad», dijo. Durante esta respuesta, el organismo trata de obtener energía adicional de la almacenada en los músculos, en forma de aminoácidos, para convertirla en glucosa y así mantener el cerebro en funcionamiento. El problema, añadió, «es que no podemos impedir esta respuesta al cáncer, aún cuando le demos al paciente los nutrientes esenciales».
Según muchos estudios, la inflamación parece ser «un tema unificador de la caquexia en muchas enfermedades, incluido el cáncer», afirmó la doctora Teresa Zimmers del Centro Oncológico Jefferson Kimmel en Filadelfia.
«Se nos presenta una enorme oportunidad terapéutica». Dr. Goldberg
«Se nos presenta una enorme oportunidad terapéutica». Dr. Goldberg
En parte, la inflamación es ocasionada por la respuesta inmunitaria del organismo al tumor, lo cual conlleva a la producción de citocinas estimuladoras de la inflamación, explicó el doctor Konstantin Salnikow de la División de Biología del Cáncer del NCI. Aún cuando estas citocinas ayudan a matar la células tumorales, parece que algunas también desvían el metabolismo del organismo hacia el catabolismo, es decir, a la descomposición de las grasas y las proteínas en los músculos.
Niveles altos de varias citocinas en particular han estado asociados íntimamente a la caquexia y la mortalidad en los pacientes con cáncer. Por ejemplo, en estudios con modelos en ratones, patrocinados por el NCI, la doctora Zimmers ha mostrado que elevados niveles de la citocina IL-6 pueden provocar caquexia. Ella y otros han comenzado a dilucidar algunos de los mecanismos posibles por medio de los cuales la IL-6 puede hacer esto.
A pesar de que no se entienda en su totalidad la biología que subyace a la caquexia relacionada con el cáncer, existen unas cuantas terapias posibles que se están abriendo paso en estudios iniciales en seres humanos.
Seguramente se necesitará más de un fármaco para combatir exitosamente la caquexia, particularmente si se encuentra en estadio avanzado, dijo la doctora Dr. Barbara Spalholz, quien también pertenece a la División de Biología del Cáncer. «Es probable que tengamos que probar diferentes opciones, dependiendo del tipo de cáncer y de otros factores», dijo.
Un fármaco en estudio es el modulador del receptor de andrógeno selectivo GTx-024 (Ostarine), formulado por la compañía GTx Inc., cuya sede se encuentra en Memphis, Tennessee. En agosto , GTx lanzó dos estudios clínicos de fase III del fármaco en fase de investigación denominado POWER1 y POWER2, para la prevención o el tratamiento de la caquexia en pacientes con cáncer de pulmón de células no pequeñas avanzado.
A pesar de la emoción que ha despertado en los laboratorios, la investigación clínica hasta el momento ha resultado decepcionante. En 2011, la firma de biotecnología GTx de Memphis, Tennessee, puso en marcha dos ensayos clínicos de fases avanzadas para enobosarm, una molécula que se une al mismo receptor que la testosterona, pero solo en músculos y huesos, imitando la capacidad de la hormona para estimular la acumulación de masa muscular pero sin efectos secundarios indeseables. Los resultados de los ensayos anteriores, más pequeños, parecían prometedores: las personas que tomaban la droga habían aumentado la masa corporal magra y mejorado su función física, la cual es medida por la velocidad de las personas al subir escaleras. Pero en las pruebas más grandes del fármaco, en las personas con cáncer de pulmón avanzado, los beneficios de función física desaparecieron. Desde entonces, la empresa ha abandonado la investigación en pérdida muscular y, en su lugar está probando dosis más grandes de enobosarm para tratar el cáncer de mama.
Cada vez más, investigadores y compañías farmacéuticas y biotecnológicas han centrado su atención en fármacos que actúan sobre varios miembros de una familia de reguladores del crecimiento que parecen ejercer una enorme influencia en el crecimiento muscular, en particular las proteínas activína y miostatina. La función primordial de la miostatina es servir de freno al crecimiento muscular. Cabras, ratones, perros y vacas con mutaciones en el gen que produce la miostatina son excesivamente musculosos. En un caso clínico publicado en 2004, se halló que un niño alemán que «lucía extraordinariamente musculoso al nacimiento, con músculos protuberantes en los muslos y los brazos», tenía una mutación genética en el gen de la miostatina.
Dos estudios de modelos en ratones publicados el año pasado, uno dirigido por la doctora Zimmers y el otro, por el doctor H. Q. Han, en la compañía biotecnológica Amgen, contenían fuertes datos probatorios de que al bloquear la actividad de la miostatina y la activina se puede ejercer un efecto considerable en la caquexia. Ambos estudios utilizaron versiones diferentes de un fármaco en fase de investigación, una forma genomanipulada de un receptor celular de la miostatina y la activina, denominado ActRIIB, que sirve de señuelo y elimina estas proteínas en el sistema circulatorio.
El estudio de la doctora Zimmers mostró que el fármaco podía potencialmente revertir la caquexia en un modelo en ratones de cáncer de colon. Con un modelo en ratones similar, el doctor Han y sus colegas mostraron que el tratamiento no solo revertía la caquexia sino que permitía a los ratones vivir mucho más que los ratones no tratados, aún cuando sus tumores continuaran creciendo. Este hallazgo fue calificado de «extraordinario» por el doctor Goldberg, coautor del estudio. Dicho estudio también fue el primero en demostrar que al actuar sobre la miostatina y la activina, se podía revertir la pérdida del músculo cardíaco provocada por la caquexia.
A pesar de los prometedores resultados obtenidos en los ratones, aún quedan preguntas por responder y retos por superar, subrayó el doctor Se-Jin Lee de la Universidad Johns Hopkins, quien descubrió la miostatina y participó en la formulación de la primera forma del fármaco ActRIIB en 2005, en colaboración con científicos de la compañía farmacéutica Wyeth, que ahora es parte de Pfizer.
«Uno de los estudios más informativos sería obtener muestras de los músculos de pacientes que están experimentando atrofia muscular para determinar si se ha activado la vía regulada por la activina y la miostatina», dijo el doctor Lee.
Probablemente deba redefinirse el fármaco ActRIIB para su uso en seres humanos, añadió, pues se une a otras proteínas además de la miostatina y la activina (una de las razones por la cuales es tan potente en los ratones), lo cual podría producir efectos secundarios inesperados e indeseados.
«Si podemos identificar una manera de interrumpir la caquexia desde el principio, podríamos en realidad evitar los efectos extendidos de la misma y mejorar la capacidad que tiene el paciente de soportar la terapia».
Dr. Salnikow
Al menos una compañía, Acceleron, con sede en Massachusetts, tiene una fármaco ActRIIB dirigido en dos estudios con seres humanos en fase II para el tratamiento de una forma de distrofia muscular. Los estudios fueron interrumpidos a principio de año debido a problemas de hemorragias relacionados con el tratamiento en los pacientes. Los representantes de Amgen no respondieron a las indagaciones sobre el estado de desarrollo en el cual se encuentra el fármaco utilizado en estudios anteriores con modelos en ratones.
«Lo atractivo de actuar en esta vía», dijo el doctor Lee, «es que aún cuando no esté desempeñando una papel causativo (en la atrofia muscular), al atacarla se podría obtener un importante beneficio clínico en cuanto a la preservación de la masa muscular.
El doctor Salnikow hizo notar que al actuar sobre la caquexia, se podría obtener un efecto indirecto en el tumor, como quitarle a las células cancerosas las moléculas que utilizan para generar energía y que son producidas por la excesiva descomposición del músculo. También tiene otras expectativas.
«Si podemos identificar una manera de interrumpir la caquexia desde el principio, podríamos en realidad evitar los efectos extendidos de la misma y mejorar la capacidad que tiene el paciente de soportar la terapia», dijo.
• ¿Existe ya algún tratamiento para la CAQUEXIA?
Como has podido leer existen algunos productos aun en investigación y esto es fácil de identificar, ya que no se manejan nombres comerciales o principios activos sino siglas, letras y números para clasificarlos…
Contestando a la pregunta… SI, SI EXISTE UN PRODUCTO PARA TRATAR LA CAQUEXIA. Es muy importante que preguntes a tu Médico tratante sobre un producto altamente especializado para Caquexia ya disponible en México a partir de este año 2017, investigaciones importantes a nivel mundial de la Farmacéutica Suiza, Helsinn han desarrollado exitosamente a través de la Innovación terapéutica un Suplemento de Amino Ácidos Esenciales, y con evidencia clínica de 4 estudios clínicos con caquexia en cáncer. (4 clinical studies in Cancer Caquexia, COPD, KF and CHF and 1 ongoing AMIXEA, study on patients with advanced non-small cell lung cáncer a randomized, doublé blind, placebo-controlled, multicentre, study).
Este texto puede copiarse o usarse con toda libertad. Sin embargo, agradeceremos que se dé reconocimiento al Instituto Nacional del Cáncer como creador de esta información. El material gráfico puede ser propiedad del artista o del editor por lo que tal vez sea necesaria su autorización para poder usarlo.
INFECCIONES DE VÍAS URINARIAS
La infección de orina está provocada por la invasión de microorganismos en el tracto urinario. Puede producirse por dos vías diferentes: por el extremo inferior de las vías urinarias (abertura en la punta del pene o de la uretra, según se trate de un hombre o de una mujer), que es el caso más frecuente; o bien a través del flujo sanguíneo, en cuyo caso la infección afecta directamente a los riñones.
Las infecciones de las vías urinarias más habituales son las producidas por bacterias, aunque también pueden presentarse a causa de virus, hongos o parásitos. De muchas de ellas es responsable la bacteria llamada Escherichia coli, que normalmente vive en el intestino. Infección de orina o del tracto urinario son expresiones que engloban diferentes enfermedades infecciosas (producidas por un microorganismo o germen) y que afectan a cualquier parte del sistema urinario (riñón, uréteres, vejiga urinaria o uretra).
Infecciones urinarias recurrentes (IUR)
Definidas generalmente en la bibliografía como 3 episodios de IU en los últimos 12 meses o 2 episodios en los últimos 6 meses, constituyen un problema clínico común especialmente en mujeres jóvenes sexualmente activas, en embarazadas, en mujeres posmenopáusicas y en pacientes con patología urológica subyacente 1-49. No sólo suponen un malestar importante en las mujeres que las padecen, sino que tienen una gran repercusión económica por los costes sanitarios que representa la asistencia sanitaria ambulatoria, las pruebas de diagnóstico y las prescripciones. La clasificación de las IUR en recidivas y reinfecciones es fundamental para determinar la actitud diagnóstico-terapéutica de las mismas.
Las recidivas representan el 20% de las recurrencias, se presentan generalmente en las primeras 2 semanas tras la aparente curación de la infección urinaria (IU) y son debidas a la persistencia de la cepa original en el foco de la infección.
Las recidivas pueden ser debidas al acantonamiento del microorganismo en un lugar inaccesible al antibiótico (pacientes con patología urológica subyacente ¬litiasis renal¬ o prostatitis crónica), o ser causadas por un tratamiento antibiótico inadecuado o demasiado corto (situación observada en ancianos o pacientes con síndrome cistítico de más de 7 días de evolución que han sido tratados durante 3 días); en realidad se trata de pielonefritis poco sintomáticas 34. Esta complicación también debe descartarse en pacientes afectados de una pielonefritis tratada adecuadamente según antibiograma durante 2 semanas y que recidivan debido a la existencia de una pielonefritis focal o bien un absceso renal subyacente, demostrados por ecografía o tomografía computarizada.
Algunos pacientes presentan recidivas sin causa aparente, es decir, después de haber realizado un tratamiento antibiótico correcto durante un tiempo adecuado y a pesar de tener un estudio urológico normal. En esta situación se aconseja administrar tratamiento antibiótico según antibiograma durante 4-6 semanas.
Tratamientos
El tratamiento para combatir las infecciones del aparato urinario incluye antibióticos, si están causadas por bacterias, o antivirales si están causadas por virus. Para administrar eficazmente uno y otro tipo de antibiótico, el médico especialista tiene la posibilidad de realizar una prueba de sensibilidad o antibiograma, que le ayuda a elegir el más efectivo contra el tipo de bacteria que está produciendo la infección. Si desea mayor información de los tipos de antibióticos consulte a su médico.
Tratamiento / Coadyuvante / Natural
Desde hace algunos años se ha visto que El Arándano Rojo ayuda en las Infecciones de vías urinarias ya que Impide que bacterias como la Escherichia coli se adhieran a las paredes del tracto urinario y así se puede eliminar con mayor facilidad. El efecto terapéutico del Arándano Rojo se debe al efecto de las PAC´s Proantocianidas, los estudios clínicos han mostrado que cuanto mayor es la concentración de las PAC´s mayor es el efecto deseado y coadyuva a incrementar el efecto benéfico del antibiótico.
En la actualidad recomiendan la ingesta de jugo de arándano, sin embargo tiene el inconveniente de las grandes cantidades de azúcar que puede contener y que nunca va a saber cuál es la concentración de PAC´s que está ingiriendose, existen algunos productos que tienen concentraciones de arándanos rojos, pero éstos tienen el inconveniente que son grado alimenticio y no están estandarizados, es decir no siempre se consume la misma concentración, para ello se requiere un Producto que se Grado Farmacéutico y esté estandarizado, asi garantizamos que siempre se estarán consumiendo las mismas cantidades de PAC´s y en la cantidad que ofrece efecto terapéutico.
Solicita a tu médico información mas precisa sobre el producto de GalaPharma a base de Arándano y en Grado Farmacéutico.
La infección de orina está provocada por la invasión de microorganismos en el tracto urinario. Puede producirse por dos vías diferentes: por el extremo inferior de las vías urinarias (abertura en la punta del pene o de la uretra, según se trate de un hombre o de una mujer), que es el caso más frecuente; o bien a través del flujo sanguíneo, en cuyo caso la infección afecta directamente a los riñones.
Las infecciones de las vías urinarias más habituales son las producidas por bacterias, aunque también pueden presentarse a causa de virus, hongos o parásitos. De muchas de ellas es responsable la bacteria llamada Escherichia coli, que normalmente vive en el intestino. Infección de orina o del tracto urinario son expresiones que engloban diferentes enfermedades infecciosas (producidas por un microorganismo o germen) y que afectan a cualquier parte del sistema urinario (riñón, uréteres, vejiga urinaria o uretra).
Cualquier anormalidad que provoque una obstrucción del flujo de orina (piedras en el riñón, estructuras anómalas, etcétera,) puede inducir a una infección urinaria.
• Una próstata dilatada puede frenar el flujo de orina, por lo que incrementa el riesgo de infección.
• Las personas sometidas a exámenes mediante tubos o catéteres o que necesitan sondas pueden desarrollar más fácilmente infecciones procedentes de dichos instrumentos.
• Los mayores se ven afectados por este tipo de infecciones con mayor frecuencia, así como las que sufren una disminución del sistema nervioso, que les impide controlar la vejiga a voluntad.
• Por otra parte, cualquier desorden que produzca una supresión en el sistema inmune incrementa el riesgo de sufrir una infección urinaria, ya que este sistema es el encargado de mantener a raya los microorganismos patógenos responsables de las infecciones.
• También se dan en bebés nacidos con alguna deformación del tracto urinario, que a menudo han de ser corregidos mediante cirugía.
Definidas generalmente en la bibliografía como 3 episodios de IU en los últimos 12 meses o 2 episodios en los últimos 6 meses, constituyen un problema clínico común especialmente en mujeres jóvenes sexualmente activas, en embarazadas, en mujeres posmenopáusicas y en pacientes con patología urológica subyacente 1-49. No sólo suponen un malestar importante en las mujeres que las padecen, sino que tienen una gran repercusión económica por los costes sanitarios que representa la asistencia sanitaria ambulatoria, las pruebas de diagnóstico y las prescripciones. La clasificación de las IUR en recidivas y reinfecciones es fundamental para determinar la actitud diagnóstico-terapéutica de las mismas.
Las recidivas representan el 20% de las recurrencias, se presentan generalmente en las primeras 2 semanas tras la aparente curación de la infección urinaria (IU) y son debidas a la persistencia de la cepa original en el foco de la infección.
Las recidivas pueden ser debidas al acantonamiento del microorganismo en un lugar inaccesible al antibiótico (pacientes con patología urológica subyacente ¬litiasis renal¬ o prostatitis crónica), o ser causadas por un tratamiento antibiótico inadecuado o demasiado corto (situación observada en ancianos o pacientes con síndrome cistítico de más de 7 días de evolución que han sido tratados durante 3 días); en realidad se trata de pielonefritis poco sintomáticas 34. Esta complicación también debe descartarse en pacientes afectados de una pielonefritis tratada adecuadamente según antibiograma durante 2 semanas y que recidivan debido a la existencia de una pielonefritis focal o bien un absceso renal subyacente, demostrados por ecografía o tomografía computarizada.
Algunos pacientes presentan recidivas sin causa aparente, es decir, después de haber realizado un tratamiento antibiótico correcto durante un tiempo adecuado y a pesar de tener un estudio urológico normal. En esta situación se aconseja administrar tratamiento antibiótico según antibiograma durante 4-6 semanas.
Es necesario que acuda a ver a su médico cuanto antes si:
• Es un adulto mayor.
• Tiene cálculos renales o cambios en la anatomía de sus vías urinarias.
• Le han realizado recientemente una cirugía de las vías urinarias.
• Tiene cáncer, diabetes, esclerosis múltiple, lesión en la médula espinal u otros problemas de salud.
• Está embarazada y tiene fiebre o cualquier otra afección.
O si requiere hospitalización su médico se lo indicará y en el hospital, le administrarán líquidos y antibióticos por vía intravenosa.
Algunas personas tienen IVU que siguen reapareciendo o que no desaparecen con tratamiento. Esas infecciones se denominan IVU crónicas. Si usted tiene una IVU crónica, puede necesitar antibióticos más fuertes o tomar medicamento por más tiempo.
Usted puede necesitar cirugía si la infección es causada por un problema de la estructura de las vías urinarias.
La causa más frecuente en los varones, de infecciones a repetición, es una infección bacteriana persistente en la próstata.
Las mujeres contraen con frecuencia infecciones de la vejiga después de una relación sexual, probablemente porque la uretra ha sufrido contusiones durante la misma. En casos muy particulares, las infecciones repetidas de la vejiga en las mujeres son originadas por una conexión anómala entre ésta y la vagina.
El cuadro clínico de la cistitis puede variar en función de la zona en la que se presente la infección. Estos son los síntomas más comunes de la infección de orina:
• Necesidad urgente y frecuente de orinar.
• Picazón o quemazón en la uretra al orinar.
• Enrojecimiento de la vulva y picor vaginal (en las mujeres).
• Dolor al orinar y en las relaciones sexuales.
• Color turbio, lechoso (espeso) o anormal de la orina.
• Aparición de sangre en la orina.
• Fiebre y escalofríos (la fiebre puede significar que la infección ha alcanzado los riñones).
• Vómitos y náuseas.
• Dolor en el costado o espalda (indica infección en los riñones).
• A menudo, las mujeres sienten una ligera presión por encima del hueso púbico y muchos hombres sienten una dilatación del recto.
• Estar más irritable de lo normal.
Los síntomas infantiles, por su parte, pueden confundirse con otros trastornos; además, los pequeños se encuentran ante la dificultad de no saber expresar qué les pasa. No obstante, si un niño presenta una infección urinaria puede manifestar los siguientes indicios:
• Estar más irritable de lo normal.
• No comer como lo hace normalmente.
• Tener fiebre sin motivo aparente que además no acaba de desaparecer.
• No poder aguantarse la orina.
• Sufrir alteraciones en su desarrollo.
• Estar más irritable de lo normal.
• No comer como lo hace normalmente.
• Tener fiebre sin motivo aparente que además no acaba de desaparecer.
• No poder aguantarse la orina.
• Sufrir alteraciones en su desarrollo.
Seguir una dieta equilibrada y llevar un estilo de vida saludable pueden ayudar a prevenir una infección urinaria; también es recomendable no retener la orina y beber agua de forma habitual, al menos dos litros diarios, ya que esto favorecerá la diuresis.
En el caso de las mujeres con menopausia, utilizar una crema de estrógenos es eficaz a la hora de reducir las posibilidades de contraer una cistitis.
Otros consejos específicos para reducir el riesgo de cistitis en mujeres son:
• Orinar después de cada coito para eliminar posibles agentes infecciosos.
• Evitar la ducha vaginal como método para reducir la posibilidad de embarazo.
• Cambiarse el bañador después de cada baño y evitar el frío en la zona.
• Tener precaución con algunos preservativos, cremas espermicidas o el diafragma, ya que no son recomendables para personas propensas a padecer infecciones urinarias. En este caso, se aconseja acudir al especialista para adoptar un método anticonceptivo diferente.
• Utilizar cremas lubricantes durante las relaciones sexuales: La irritación vaginal postcoital es una causa muy frecuente de infección en la vejiga; el uso de lubricantes es una forma eficaz de evitar el roce y, por lo tanto, posibles infecciones.
En el caso de los bebés y niños, es importante cambiar los pañales de forma frecuente, así como instruir a los niños en los hábitos higiénicos que deben realizar después de haber orinado o defecado.

• Bacteriuria: Es la presencia de bacterias que aparecen en un análisis de orina.
• Infecciones de tracto urinario inferior: Son de varios tipos. La cistitis se produce en la vejiga, mientras que la uretritis se localiza en la uretra. En el caso de los hombres, la infección urinaria puede producirse en la próstata (prostatitis) o en los conductos encargados de la producción y excreción del semen (orquiepididimitis).
• Infecciones de tracto urinario superior: Se denomina así a otro tipo de infecciones más graves, como la pielonefritis aguda, que afecta a los riñones.
• Infecciones urinarias no complicadas: Son infecciones banales que no presentan otras patologías, como la cistitis o pielonefritis.
• Infecciones urinarias complicadas: Cuando existen otras patologías como alteraciones metabólicas, inmunodepresión o la aparición de patógenos inusuales. Pueden afectar tanto a niños como a mujeres embarazadas y hombres.
• Infecciones urinarias recurrentes: Son infecciones que vuelven a aparecer causadas por el mismo microorganismo o por otro.
• Infección urinaria crónica: La infección urinaria se cronifica cuando no termina de desaparecer a pesar de los tratamientos.
Las pruebas y análisis que tendrán que realizarse al paciente con cistitis dependerán de la zona donde se presume que radica la infección y de los síntomas que éste padezca. Algunas de las pruebas más generales son las siguientes:
• Examen físico: El médico palpa la zona abdominal y pélvica del paciente para detectar los lugares con dolor o con enrojecimiento.
• Análisis de orina: Con una muestra de orina del paciente se examina si ésta contiene algún agente infeccioso (germen nocivo).
• Cultivos de orina, líquido vaginal o líquido uretral: Se siembra una gota de algunos de estos líquidos en una placa con nutrientes para bacterias y, después de transcurridas varias horas para que éstas crezcan, se determina qué tipo de bacteria es la causante de la infección y qué antibióticos pueden resultar efectivos (antibiograma).
• Citoscopia: Consiste en introducir por la uretra un tubo provisto de lentes y luz para observar directamente el estado de la uretra y la vejiga urinaria.
• Ecografía abdominal: Es un estudio indoloro del abdomen que se realiza mediante ultrasonidos que forman una imagen en un monitor.
• Urografía: Es una radiografía del riñón, para la cual hay que inyectar previamente una sustancia que creará un contraste y el riñón podrá ser observado con facilidad.
La mayoría de las IVU se puede curar. Los síntomas de una infección de la vejiga en la mayoría de los casos desaparecen al cabo de 24 a 48 horas después de que empieza el tratamiento. Si usted tiene una infección renal, puede pasar 1 semana o más tiempo para que sus síntomas desaparezcan.
Las complicaciones pueden incluir:
Infección de la sangre potencialmente mortal (sepsis). El riesgo es mayor para los jóvenes, los adultos de edad muy avanzada y aquellos cuyos cuerpos no pueden combatir las infecciones (por ejemplo, debido a VIH o quimioterapia para el cáncer).
Cicatrización o daño renal.
Infección renal.
Consulte a su Médico si presenta síntomas de una Infección de Vías Urinarias, llame de inmediato si se presentan signos de una posible infección renal, por ejemplo:
Dolor de espalda o de costado
• Escalofríos
• Fiebre
• Vómitos
• Llame también si los síntomas regresan poco después de haber recibido tratamiento con antibióticos.
Los cambios en el estilo de vida y en la dieta pueden ayudar a prevenir algunas infecciones de las vías urinarias. Después de la menopausia, una mujer puede usar crema de estrógenos alrededor de la vagina para reducir las infecciones.
El tratamiento para combatir las infecciones del aparato urinario incluye antibióticos, si están causadas por bacterias, o antivirales si están causadas por virus. Para administrar eficazmente uno y otro tipo de antibiótico, el médico especialista tiene la posibilidad de realizar una prueba de sensibilidad o antibiograma, que le ayuda a elegir el más efectivo contra el tipo de bacteria que está produciendo la infección. Si desea mayor información de los tipos de antibióticos consulte a su médico.
Desde hace algunos años se ha visto que El Arándano Rojo ayuda en las Infecciones de vías urinarias ya que Impide que bacterias como la Escherichia coli se adhieran a las paredes del tracto urinario y así se puede eliminar con mayor facilidad. El efecto terapéutico del Arándano Rojo se debe al efecto de las PAC´s Proantocianidas, los estudios clínicos han mostrado que cuanto mayor es la concentración de las PAC´s mayor es el efecto deseado y coadyuva a incrementar el efecto benéfico del antibiótico.
En la actualidad recomiendan la ingesta de jugo de arándano, sin embargo tiene el inconveniente de las grandes cantidades de azúcar que puede contener y que nunca va a saber cuál es la concentración de PAC´s que está ingiriendose, existen algunos productos que tienen concentraciones de arándanos rojos, pero éstos tienen el inconveniente que son grado alimenticio y no están estandarizados, es decir no siempre se consume la misma concentración, para ello se requiere un Producto que se Grado Farmacéutico y esté estandarizado, asi garantizamos que siempre se estarán consumiendo las mismas cantidades de PAC´s y en la cantidad que ofrece efecto terapéutico.
Solicita a tu médico información mas precisa sobre el producto de GalaPharma a base de Arándano y en Grado Farmacéutico.
Dermatitis Inducida por Radioterapia
Algunas personas que se han sometido a radioterapia desarrollan Dermatitis por Radioterapia (DIRT) durante su tratamiento de quimioterapia. La piel en una zona que ha recibido radiación se vuelve roja, un tono desde claro a muy brillante. La piel puede ampollarse o pelarse, sensibilizarse e inflamarse. Esto puede parecerse a una quemadura solar grave, pero también pueden ser úlceras dolorosas. Puede aparecer semanas o meses después de la administración de la radiación. No están claras las causas de la DIRT. Si bien no es frecuente, la DIRT aparece mayormente en personas que tienen:
• Intervalos breves entre la radioterapia y la quimioterapia (usualmente, dos meses o menos)
• Trastornos de la piel anteriores
• Deficientes hábitos nutricionales
• El tratamiento simultáneo contra el cáncer de la cabeza o del cuello con quimioterapia.
Ciertas condiciones de salud también pueden aumentar el riesgo. Estos incluyen lo siguiente:
• Trastornos del tejido conectivo, como Lupus eritematoso sistémico o esclerosis sistémica
• Infecciones, como el VIH:
• Diabetes
• Obesidad
Si tiene síntomas de DIRT, es importante que hable con el equipo de atención médica de inmediato. Si tiene una reacción cutánea grave, es posible que deba esperar hasta que la piel sane antes de reanudar la quimioterapia.
Para ayudar a que la piel sane, es posible que el médico recomiende tomar medicamentos antiinflamatorios no esteroideos (AINES) y corticosteroides. Además de los medicamentos, otras medidas que pueden ser beneficiosas incluyen:
• Usar las cremas con esteroides recomendadas por el médico.
• Usar lociones, humectantes o geles para calmar la irritación de la piel.
• Evitar la exposición a los rayos solares ultravioletas. Si debe salir, utilizar filtro solar. Además, evitar camas solares, que pueden dañar aún más la piel.
• Vestirse cómodamente con prendas hechas de fibras naturales, como el algodón.
• Usar jabón suave para la piel.
• Colocarse una compresa fría en la zona dolorida.
• Evitar elementos irritantes, como perfumes o productos a base de alcohol.
La DRIT no afecta a todas las personas que se someten a radioterapia y luego a quimioterapia. Si experimenta este efecto secundario, su equipo de atención médica puede ayudarlo a sanarse y a continuar con su tratamiento.
Tratamiento:
Como podemos observar los tratamientos que hoy en día se siguen utilizando nos son del todo específicos para Dermatitis Inducida por Radio Terapia, sino mas bien son remedios cosméticos, es importante consultar a tu Médico y preguntar por productos Altamente Especializados para estos casos como lo es, el que ya estará en México con GalaPharma formulado a base de Ácido Hialurónico.
Fuente de la Información Científica:
American Cancer Society
http://www.cancer.org
National Cancer Institute
http://www.cancer.gov
Bibliografía:
Hird AE, Wilson J, Symons S, Sinclair E, Davis M, Chow E. Radiation recall dermatitis: case report and review of the literature. Curr Oncol. 2008;15(1):53-62.
Radiation dermatitis. DermNetNZ website. Available at: http://www.dermnetnz.org/reactions/radiation-dermatitis.html. Updated December 29, 2013. Accessed March 5, 2014.
Schub T, Caple C. Radiation recall dermatitis. EBSCO Nursing Reference Center website. Available at: http://www.ebscohost.com/nursing/products/nursing-reference-center. Updated June 18, 2013. Accessed March 5, 2014.
Última revisión March 2014 por Michael Woods, MD
La información aquí suministrada complementa la atención recibida por su médico. De ninguna forma intenta sustituir el consejo de un profesional médico. LLAME A SU MEDICO DE INMEDIATO SI PIENSA QUE PODRIA TENER UNA EMERGENCIA. Siempre busque consejo médico antes de comenzar un nuevo tratamiento o si tiene preguntas sobre una condición médica.
La radioterapia es una modalidad de tratamiento común para muchos tipos de cáncer. El aproximadamente 75% de pacientes de oncología recibirán radioterapia como componente del cuidado curativo o paliativo (Sociedad Americana para la Oncología de Radiación, 2010). La radioterapia trabaja entregando una dosis exacta de radiación al tumor y dañando el ADN de la célula de cáncer, así deteriorando el crecimiento de la célula y accionando la muerte de la célula (Sociedad Americana para la Oncología de Radiación, 2010). El daño del ADN puede ocurrir directamente, de la exposición a la irradiación, e indirectamente, vía ionización del agua y producción de radicales libres (Hymes, Strom, y Fife, 2006). La meta de la radioterapia es irradiar las células del tumor mientras que reduce al mínimo el daño al tejido fino normal. Sin embargo, las células normales en el campo de radiación se pueden también dañar por la exposición a la radiación. Típicamente, los tejidos finos normales son capaces de repararse uno mismo, pero la exposición de radiación repetida crea un desequilibrio del daño y de la reparación del tejido fino (Hymes, Strom, y Fife, 2006). El ejemplo más común del daño del tejido fino normal como resultado de la radioterapia es cambios inducidos por la radiación a la piel, o radiodermatitis.
El aproximadamente 95% de pacientes de oncología de radiación experimentarán radiodermatitis moderada y el 87% experimentarán radiodermatitis severa durante o después de su terapia (McQuestion, 2006; Fisher y otros, 2000). La radiodermatitis puede ser aguda o crónica, e incluye eritema y edema localizada, mudar de la piel (descamación), pérdida del pelo (depilación), fibrosis, y necrosis. La radiodermatitis puede ser dolorosa y embarazosa, y se ha asociado a calidad de vida disminuida (Fisher y otros, 2000). Además, la radiodermatitis severa hace necesario modificaciones o retraso del tratamiento, que pueden comprometer la eficacia de la radioterapia (Hymes, Strom, y Fife, 2006). Dado el alcance y la severidad de la radiodermatitis, es crucial que las enfermeras de oncología estén al corriente de la presentación clínica y de las intervenciones basadas en la evidencia para la radiodermatitis.
Sin embargo, un estudio de investigación de D’haese y otros (2005) encontró que hay discrepancia amplia entre las intervenciones de las enfermeras para la prevención y la gerencia de la radiodermatitis. D’ haese y otros entrevistaron a enfermeras de oncología de radiación en Bélgica y encontraron solamente un pequeño a moderado nivel de acuerdo entre las enfermeras con respecto a la prevención y la gerencia de la radiodermatitis. La variación más grande estaba entre las prácticas preventivas. Estos resultados sugieren que hay confusión entre las enfermeras de oncología, y probablemente sus pacientes, con respecto a la prevención y a la gerencia de la radiodermatitis.

La piel es el órgano más grande del cuerpo y se compone de dos capas, la epidermis y el dermis. La capa más superficial, la epidermis, se compone de una capa delgada (< 2 milímetros) de células escamosas queratinizadas que sirven como barrera protectora contra patógenos y previenen la pérdida de agua del cuerpo (McQuestion, 2006). La capa cutánea es levemente más gruesa (1-3 milímetros) y contiene vasos sanguíneos que alimentan la piel y asisten con la termorregulación (Harper, Franklin, Jenrette, y Aguero, 2004). El dermis también contiene los nervios que son responsables de la sensación, las glándulas que están implicadas en la función inmune, y los folículos del pelo (McQuestion, 2006). La piel se está renovando continuamente. Las células nuevas de la piel se proliferan y maduran en la capa cutánea y emigran a la epidermis durante dos a tres semanas (Harper y otros, 2004).
La radiodermatitis puede ser aguda o crónica y existe en una serie continua de eritema, depilación, descamación, ulceración, o necrosis. Los cambios agudos de la piel ocurren en el plazo de 90 días de iniciar la terapia como resultado de la inflamación mediada por los citoquinas y del daño del ADN (Hymes, Strom, y Fife, 2006; Muller, Khan, Port, Abend, Molls, Ring, y Meineke, 2006). El eritema y la hinchazón pueden comenzar dentro de horas o de días de iniciar la radioterapia debido al lanzamiento de citoquinas que causan la dilatación capilar, la infiltración del leucocito, y la hinchazón localizada (Hymes, Strom, y Fife, 2006; McQuestion, 2006).
La sequedad y depilación pueden ocurrir dentro de días a semanas debido al daño a las glándulas y folículos sebáceos del pelo en la capa cutánea (McQuestion, 2006). La descamación seca, caracterizada por sequedad, escalamiento, y prurito, puede ocurrir típicamente después de la tercera semana o después de una dosis acumulativa de 30 Gy debido a la destrucción de las células basales regeneradoras (Richardson, Smith, McIntyre, Thomas, y Pilkington, 2005). La descamación seca se resuelve típicamente en el plazo de una a dos semanas de la terapia (McQuestion, 2006). La descamación húmeda, evidenciada por dermis roja, expuesta y exudación serosa, ocurre después de cuatro a cinco semanas de la terapia o con una dosis acumulativa de 45 a 60 Gy mientras las células basales se agotan más a fondo (Richardson y otros, 2005). La radiodermatitis aguda se resuelve generalmente en el plazo de tres a cuatro semanas después de la terapia (McQuestion, 2006).
Los efectos tardíos pueden ocurrir dondequiera a partir de 90 días a años después de terminar la terapia como resultado de daño permanente al dermis (Harper, Franklin, Jenrette, y Aguero, 2004). Los cambios tardíos inducidos por la radiación de la piel incluyen atrofia, fibrosis, telangiectasias, y cambios en la pigmentación. La radiación destruye los fibroblastos en el dermis, dando por resultado la reabsorción del colágeno y la atrofia del tejido fino (Harper y otros, 2004). Sin embargo, la radiación también estimula el crecimiento de los fibroblastos anormales que producen el tejido fino denso, fibroso (Harper y otros, 2004). La fibrosis inducida por la radiación es caracterizada por induración progresiva, edema, y espesar del dermis (Harper y otros, 2004). La radiación también daña la vasculatura de la capa cutánea y los vasos sanguíneos llegan a ser prominentes, dilatados, y finos, también conocido como telangiectasias (Harper y otros, 2004). La exposición de la irradiación puede destruir los melanocitos cutáneos, conduciendo a la hipopigmentación, o puede accionar la producción creciente de melanina en la piel, causando la híperpigmentación (Harper y otros, 2004).
La asesoría de la radiodermatitis debe utilizar una herramienta validada para la evaluación. El Grupo de Oncología de la Radioterapia (RTOG, por sus siglas en ingles) y el Instituto Nacional del Cáncer (NCI, por sus siglas en ingles) han establecido herramientas similares para la evaluación que clasifican la radiodermatitis por severidad.
En resumen, la radiodermatitis leve (el grado 1 de RTOG y de NCI) es caracterizada por eritema leve, blanqueada, o descamación seca. El inicio es típicamente dentro de días a semanas de iniciar la terapia y los síntomas pueden se descoloración dentro de un mes (McQuestion, 2006). La descamación seca se puede asociar al prurito, depilación, escalamiento, y posiblemente cambios en la pigmentación. Los pacientes con radiodermatitis leve pueden divulgar que su piel se siente firme (McQuestion, 2006). La pérdida de pelo ocurre en el campo del tratamiento y es a menudo temporal, pero puede llegar a ser permanente en algunos pacientes (McQuestion, 2006).
La radiodermatitis moderada (grado 2) es a menudo dolorosa y presenta como edema y descamación húmeda que se localiza a los pliegues de la piel (Hymes, Strom, y Fife, 2006). Bullas pueden también estar presentes. Es importante observar que la descamación humeda indica que la integridad del dermis está deteriorada y los pacientes están así en riesgo creciente para la infección con Estafilococo áureo (Hymes, Strom, y Fife, 2006). Por lo tanto, los pacientes con descamación humeda deben ser supervisados para evidencia de infección, tal como drenaje purulento y fiebres, y ser educados sobre la necesidad de divulgar cualquier síntoma de infección.
En la radiodermatitis severa (grado 3 y 4), el área de la descamación húmeda se ha separado a las áreas fuera de los pliegues de la piel. La radiodermatitis de grado 4 indica que úlceras, hemorragias, y/o necrosis del tejido fino están presentes. Las úlceras pueden ser rojas con bordes levantados con una base roja o negra (McQuestion, 2006). Desafortunadamente, la ulceración es muy dolorosa y no se cura bien (Gerlach, 2005).
Los cambios crónicos de la piel pueden no desarrollarse por meses o años después de la radioterapia. La radiodermatitis crónica resulta de cambios permanentes a la capa cutánea, dando por resultado fibrosis, a telangiectasias, depilación, y atrofia. El RTOG también ha establecido criterios para calificación que son específicos para la radiodermatitis crónica. Resumiendo, el grado 1 es caracterizado por atrofia leve. En el grado 2, hay áreas desiguales de atrofia, telangiectasias, y depilación. Atrofia marcada y telangiectasias gruesas llenan los criterios del RTOG para el grado 3. La radiodermatitis crónica de grado 4 implica la ulceración.
Los factores de riesgo para la radiodermatitis pueden ser tratamiento-relacionados o paciente-relacionados. Los factores de riesgo tratamiento-relacionados incluyen: tipo/calidad de haz, dosis y fraccionamiento total, localización y tamaño del campo de tratamiento, y presencia de campos traslapados (Hymes, Strom, y Fife, 2006; Bernier y otros, 2008). El riesgo de un paciente para la radiodermatitis es generalmente proporcional al grado de exposición de piel a la irradiación. Las técnicas modernas de la radioterapia, incluyendo la radioterapia intensidad-modulada (IMRT, por sus siglas en ingles) y la terapia de protón, pueden reducir al mínimo el riesgo para la radiodermatitis más exactamente apuntando el tumor y así ahorrando el tejido fino normal. Consecuentemente, IMRT se ha encontrado disminuir perceptiblemente la radiodermatitis aguda (McDonald, Godette, Butler, Davis, y Johnstone, 2008; Pignol y otros, 2008). El fraccionamiento de dosis entrega una dosis diaria más pequeña de radiación y también se ha encontrado disminuir el riesgo para la radiodermatitis (Chan, Teoh, Sanghera, y Hartley, 2009).
Las medicaciones específicas, incluyendo algunos agentes de quimioterapia, se saben ser los radiosensibilizadores que refuerzan el efecto de la radiación y pueden aumentar el riesgo de un paciente para los efectos secundarios tales como la radiodermatitis. La quimioterapia y radioterapia concurrente puede también aumentar y prolongar la radiodermatitis (Giro y otros, 2009).
Los factores de riesgo paciente-relacionados incluyen: obesidad y presencia de pliegues de la piel, estado alimenticio pobre, fumar, exposición UV concurrente, radiosensibilidad individual, y condiciones comorbilidades tales como ataxia-telangiectasias y enfermedades autoinmunes (Yarbro, Frogge, y Goodman, 2004; Hymes, Strom, y Fife, 2006). Los pliegues de la piel dentro del campo de radiación intensifican la dosis que se entrega a esa área específica que aumenta así el riesgo para la toxicidad. El estado alimenticio pobre y el fumar pueden exacerbar la radiodermatitis afectando la curación de la herida. Las enfermedades autoinmunes, tales como escleroderma, eritematosa sistémica de lupus, y posiblemente la artritis reumatoide, se creen ser indicadores de radiosensibilidad creciente (Hymes, Strom, y Fife, 2006). Hay también algunas mutaciones genéticas raras que pueden predisponer a pacientes a la radiodermatitis severa, incluyendo mutaciones en el gene de telangiectasias ataxia (ATM, por sus siglas en ingles) y el gene patch (PTCH, por sus siglas en ingles) (Hymes, Strom, y Fife, 2006).
La historia del tratamiento del paciente, específicamente su duración y la dosis acumulativa de la radioterapia, proporcionará la mejor pista en cuanto a la diagnosis de la radiodermatitis. Sin embargo, hay varias otras diagnosis diferenciadas a considerar que incluyen dermatitis por radioterapia, celulitis, eczema, y malignidad secundaria.
La dermatitis por radioterapia es una reacción inflamatoria de la piel que ocurre en un área previamente irradiada después de la administración de una droga. Las drogas citotóxicas tales como docetaxel, doxorubicina, y paclitaxel se han asociado a la dermatitis por radioterapia (Chen y otros, 2009; Yeo y Johnson, 2000). La dermatitis por radioterapia puede presentar como eritema, ulceración, hemorragia, o aún necrosis y puede ocurrir meses a años después de la radioterapia (Hymes, Strom, y Fife, 2006). La dermatitis por radioterapia se resuelve generalmente espontáneamente con la gerencia del síntoma y el cuidado de apoyo (Yeo y Johnson, 2000). Una historia exacta de la radioterapia y las medicaciones del paciente ayudarán a determinar si la dermatitis puede ser debido a dermatitis por radioterapia.
La celulitis es una infección del dermis o de los tejidos finos subcutáneos que es caracterizada por rojez localizada, hinchazón, fiebres y posiblemente drenaje purulento (Fiebach, Kern, Thomas, y Ziegelstein, 2007). La integridad alterada de la piel secundaria a la radiodermatitis puede predisponer a un paciente a la celulitis (Hill, Bogle, y Duvic, 2004). Otros factores de riesgo para la celulitis incluyen el sistema inmune debilitado, hinchazón crónica como con linfedema, y condiciones de la piel tales como eczema (Stevens y Eron, 2009). La diagnosis de celulitis se puede confirmar por una cultura del drenaje de la herida o se puede tratar empíricamente con antibióticos (Fiebach, Kern, Thomas, y Ziegelstein, 2007). La diferencia dominante entre la radiodermatitis y la celulitis es que los pacientes con celulitis presentarán con evidencia de infección, tal como drenaje purulento y fiebres.
Eczema, o dermatitis atópica, es una condición inflamatoria de la piel crónica, recayente, que es diagnosticada por la presentación clínica de la piel seca simétrica, prurítica, que persiste por seis meses o más (Saeki y otros, 2009). En adultos, el eczema tiende ser peor en la cara, el pecho, y el trasero (Saeki y otros, 2009). El eczema crónico puede exacerbar la radiodermatitis pues ambas condiciones son inflamatorias en naturaleza (Hymes, Strom, y Fife, 2006). El tratamiento para el eczema se basa en la severidad del síntoma, pero incluye a menudo una combinación de crema hidratante tópica y corticoesteroide tópico (Saeki y otros, 2009). Eczema puede ser distinguido de la radiodermatitis por su distribución simétrica. En cambio, la radiodermatitis aparecerá solamente en los campos de radiación.
Un malignidad secundaria de la piel, aunque un efecto secundario raro de la radiación, necesita ser eliminada (Pierard, Pierard-Franchemont, Paquet, y Quatresoaz, 2009). Además, la incidencia del cáncer primario de la piel es alta; aproximadamente uno en cinco americanos desarrollará el cáncer de la piel en su curso de vida (Sociedad Americana del Cáncer, 2008). La presentación del cáncer de la piel varía por el tipo, pero puede incluir lesiones de la piel anormales con fronteras irregulares, variación del color, y asimetría (Gordon, 2009). Los factores de riesgo para el cáncer de la piel incluyen la tez clara, historia de quemaduras severas del sol, antecedentes familiares o personales del cáncer de la piel, historia de nevos displásticos, exposición al sol o camas de broncear, y un sistema inmune debilitado (Gordon, 2009). Una biopsia de la piel es necesaria para confirmar una malignidad y determinar el curso de tratamiento (Gordon, 2009).
Numerosas «lociones y pociones» se han sugerido para la prevención y manejo de la radiodermatitis, tal como ácido ascórbico, vitamina D, sábila, cremas de manzanilla y caléndula, y ungüento de almendra. Otras prácticas comunes incluyen evitar las cremas basadas en cinc y aluminio y los desodorizantes, usar ropa floja de algodón, y aplicarse vendajes que no se pegan (Harper, Franklin, Jenrette, y Aguero, 2004). Sin embargo, hay datos científicos limitados para apoyar estas recomendaciones (Kassab, Cummings, Berkovitz, Van Haselen, y Fisher, 2009). Las recomendaciones siguientes se basan en la mejor evidencia actual, incluyendo un meta-análisis de 28 estudios controlados seleccionados al azar por el Grupo de las Pautas del Cuidado de Apoyo (SCGG, por sus siglas en inglés) (Bolderston, Lloyd, Wong, Holden, y Robb-Belnderman, 2006). El manejo de la radiodermatitis se debe basar en la severidad de los síntomas y la comodidad del paciente.
El eritema leve es manejado lo mejor posible lavándose suavemente con un jabón o un champú suave (Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006). El lavado reduce la carga bacteriana y el riesgo de infección (Hymes, Strom, y Fife, 2006). De hecho, el jabón suave y el agua se han encontrado ser más eficaces en la prevención y el tratamiento de la radiodermatitis que la sábila tópica (Richardson, Smith, McIntyre, Thomas, y Pilkington, 2005). A contrario a la creencia popular, el uso de desodorante durante la radioterapia no aumenta el riesgo de un paciente para la radiodermatitis (Theberge, Harel, y Dagnault, 2009).
El cuidado de la descamación seca debe apuntar a humedecer el área y reducir al mínimo el malestar del paciente. Una crema no-perfumada, hidrofílica, libre de lanolina se puede utilizar para el tratamiento de la descamación seca y/o la prevención de la descamación húmeda (Harper, Franklin, Jenrette, y Aguero, 2004; Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006). Hay también una cierta evidencia para sugerir que los esteroides tópicos pueden ser benéficos. Los esteroides tópicos inhiben la regulación por incremento de citoquinas en respuesta a la radiación. Un estudio seleccionado al azar de control por Bostrom y otros (2001) probaron cremas profilácticas de corticoesteroide y crema de emoliente contra la crema de placebo durante la radioterapia y por tres semanas siguiendo la terminación de la terapia. Una frecuencia perceptiblemente más baja de la radiodermatitis fue encontrada en el grupo del corticoesteroide, que sugiere que los esteroides tópicos puedan prevenir la radiodermatitis. El SCGG apoya el uso de un corticoesteroide tópico de dosis baja para relevar la comezón e irritación (Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006). Sin embargo, las cremas tópicas deben ser descontinuadas si la descamación húmeda se desarrolla (Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006). Las pautas no recomiendan el uso de sucralfato, Biafine, ácido ascórbico, sábila, crema de manzanilla, ungüento de almendra, o selladores adhesivos de la piel de polímero para la prevención o el tratamiento de la radiodermatitis debido a evidencia escasa (Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006).
Vendajes de hidrocoloideas o hidrogel, con o sin crema para humedecer, se han utilizado tradicionalmente en el manejo de la descamación húmeda para promover un ambiente húmedo para la re-epitelización (Hymes, Strom, y Fife, 2006; Harper, Franklin, Jenrette, y Aguero, 2004). Los hidrogels se han encontrado ser superiores a la genciana violeta en la curación de la descamación húmeda (Gollins, Gaffney, Slade, & Swindell, 2008). Sin embargo, un estudio reciente que comparó el hidrogel contra vendaje seco en la época curativa de la descamación húmeda encontró que el tiempo curativo fue prolongado perceptiblemente en el grupo de hidrogel (Macmillian y otros, 2007).
Una explicación posible para este encuentro es que mientras que una dosis de ambiente húmedo promueve la curación de la herida, demasiada humedad conduce a la maceración. En respuesta, varios estudios de casos pequeños han tratado vendajes más finos hechos de silicón (MacBride, Wells, Hornsby, Sharp, Finnila, y Downie, 2008) o hidrocoloideas (Russi, Merlano, Comino, y Numico, 2007). Los datos preliminares sugieren que preparaciones más finas son seguras y toleradas bien, pero estudios controlados seleccionados al azar más grandes son necesarios para evaluar la eficacia de estos vendajes (MacBride y otros; Russi y otros). El SCGG también determinó que hay evidencia escasa para recomendar un tipo particular de vendaje para el manejo de la descamación húmeda (Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006). El SCGG no hizo recomendaciones para cuándo modificar o llevar a cabo la radioterapia debido a la radiodermatitis severa (Bolderston, Lloyd, Wong, Holden, y Robb-Benderman, 2006). Por lo tanto, la decisión a modificar o aguantar la radioterapia debe ser hecha de acuerdo a la decisión del Radio Oncólogo.
La radiodermatitis es un efecto secundario común de la radioterapia que se asocia al dolor, calidad de vida disminuida, y retraso en el tratamiento que puede comprometer la eficacia de la radioterapia, ya que por la lesión y afectación del paciente puede posponerse, prolongar los tiempos de tratamiento o incluso suspenderse. (McQuestion, 2006; Fisher y otros, 2000; Hymes, Strom, y Fife 2006).
La radiodermatitis se extiende de leve a severa y puede ser aguda o crónica en naturaleza. El manejo de la radiodermatitis se debe basar en la severidad de los síntomas, según lo determinado por el grado de RTOG o de NCI, y debe promover la curación de la herida y comodidad del paciente. En un mínimo, la investigación indica que todos los pacientes deben ser permitidos ducharse, con jabón suave y agua, y utilizar desodorante.
Las enfermeras de oncología juegan un papel crítico en el manejo de la radiodermatitis.
Como se ha observado en el pasado, no se contaba con medicamentos o productos especializados y con estudios clínicos que avalen la efectividad, sin embargo estudios científicos recientes, a través de la Innovación de Helsinn, le permitieron Investigar y Desarrollar un producto altamente especializado para la Dermatitis Inducida por Radio Terapia, pregunta a tu Médico por el producto de GalaPharma…

American Cancer Society (2008). Cancer Facts & Figures. Retrieved from www.cancer.org/downloads/STT/2008CAFFfinalsecured.pdf
Bernier, J., Bonner, J., Vermorken, J.B., Bensadoun, R.J., Dummer, R., Giralt, J., Kornek, G., Hartley, A., Mesia, R., Robert, C., Segaert, S., & Ang, K.K. (2008). Consensus guidelines for the management of radiation dermatitis and coexisting acne-like rash in patients receiving radiotherapy plus EGFR inhibitors for the treatment of squamous cell carcinoma of the head and neck. Annals of Oncology, 19(1), 142-149.
Bolderston, A., Lloyd, N.S., Wong, R.K., Holden, L., & Robb-Benderman, L. (2006). The prevention and management of acute skin reactions related to radiation therapy: A systematic review and practice guideline. Supportive Care Cancer, 14, 802–817. DOI: 10.1007/s00520-006-0063-4
Bostrom, A., Lindman, H., Swartling, C., Berne, B., Bergh, J., & Bergh, J. (2001). Potent corticosteroid cream (mometasone furoate) significantly reduces acute radiation dermatitis: Results from a double-blind, randomized study. Radiotherapy Oncology, 59, 257-265.
Chan, A., Teoh, D., Sanghera, P., & Hartley, A. (2009). Radiotherapy compliance is maintained with hypofractionation and concurrent cetuximab in locally advanced head and neck cancer. Radiotherapy and Oncology, 93(3), 654-661. DOI: 10.1016/j.radonc.2009.05.005
Chen, S.S., Strauss, J.B., Shah, A.P., Rao, R.D., Bernard, D.A., & Griem, K.L. (2009). Radiation recall reaction with docetaxel administration after accelerated partial breast irradiation with electronic brachytherapy. Brachytherapy, 8(3), 331-334.
D’haese, S., Bate, T., Claes, S., Boone, A., Vanvoorden, V., & Efficace, F.(2005). Effective management of skin reactions during radiotherapy: A study of nursing practice. European Journal of Cancer Care, 14, 28-42.
Fiebach, N.H., Kern, D.E., Thomas, P.A., & Ziegelstein, R.C.(Ed). (2007). Principles of ambulatory medicine. Philadelphia: Lippincott Williams & Wilkins.
Fisher J, Scott C, Stevens R, Marconi, B., Champion, L., Freedman, G.M., Asraris, F., Pilepich, M.V., Gagnon, J.D., & Wong, G. (2000). Randomized phase III study comparing best supportive care to Biafine as a prophylactic agent for radiation-induced skin toxicity for women undergoing breast irradiation: Radiation therapy oncology group (RTOG) 97-13. International Journal of Radiation Oncology, Biology, Physics, 48, 1307-1310.
Gerlach, M.A. (2005). Wound care issues in the patient with cancer. Nursing Clinics of North America, 40, 295-323.
Giro, C., Berger, B., Bolke, E., Giernik, F., Duprez, F., Locati, L., Maillard, S., Ozshin, M., Pfeffer, R., Robertson, A.G., Langendijk, J.A., & Budach, W. (2009). High rates of severe radiation dermatitis during radiation therapy with concurrent cetuximab in head and neck cancer: Results of survey in EORTC institutes. Radiotherapy and Oncology, 90, 166-171.
Gollins, S., Gaffney, C., Slade, S., & Swindell, R. (2008). RCT on gentian violet versus a hydrogel dressing for radiotherapy-induced moist skin desquamation. Journal of Wound Care, 17(6), 268-270, 272, 274-275.
Gordan, R.M. (2009). Skin cancer: More than skin deep. The Nurse Practitioner, 34(4), 21–27.
Hill, A., Bogle, & Duvic, (2004). Severe radiation dermatitis is related to Staphylococcus aureus. American Journal of Clinical Oncology, 27(4), 361-363.
Hymes, S.R., Strom, E.A., & Fife, C. (2006). Radiation dermatitis: Clinical presentation, pathophysiology, and treatment 2006. Journal of the American Academy of Dermatology, 54(1), 28-46. DOI: 10.1016/j.aad.2005.08.054
Kassab, S., Cummings, M., Berkovitz, S., Van Haselen, R., & Fisher, P. (2009). Homeopathic medications for the adverse effects of cancer treatments. Cochrane Database of Systemic Reviews, 2. DOI: 10.1002/146518.58.cd00485
MacBride, Wells, Hornsby, Sharp, Finnila, & Downie, (2008). A case study to evaluate a new soft silicone dressing, Mepilex Lite, for patients with radiation skin reactions. Cancer Nursing, 31(1), 8-14.
Macmillan, M.S., Wells, M., MacBride, S., Raab, G.M., Munro, A., & MacDougall, H. (2007). Randomized comparison of dry dressings versus hydrogel in management radiation-induced moist desquamation. International Journal of Radiation Oncology Biological Physiology 68 (3), 864-872. DOI: 10.1016/j.ijrobp.2006.12.04
McDonald, M.W., Godette, K.D., Butler, E.K., Davis, L.W., Johnstone, P.A.S. (2008). Long-term outcomes of IMRT for breast cancer: A single-institution cohort analysis. International Journal of Radiation Oncology, Biology, Physics, 72(4), 1031-1040. DOI: 10.1016/j.irobp.2008.02.053
McQuestion, M. (2006). Evidenced-based skin care management in radiation therapy. Seminars in Oncology Nursing, 22(3), 163-173. DOI: doi:10.1016/j.soncn.2006.04.004
Muller, K., Khan, F.M., Port, M., Abend, M., Molls, M., Ring, J., & Meineke, V. (2006). Intercellular adhesion molecule-1: a consistent inflammatory marker of the cutaneous radiation reaction both in vitro and in vivo British Journal of Dermatology, 155, 670-679. DOI: 10.1111/j.1365-2133.2006.07407.x
National Cancer Institute (1999). Common toxicity criteria (CTC), version 2.
Omidvari, S., Saboori, H., Mohammadianpanah, M., Mosalaei, A., Ahmadloo, N., Mosleh-Shirazi, M., Jowkar, F., & Namaz, S. (2007). Topical betamethasone for prevention of radiation dermatitis. Indian Journal of Dermatology, Venereology, and Leprology, 73, 209-214.
Pierard, G.E., Pierard-Franchemont, C., Paquet, P., & Quatresoaz, P. (2009). Emerging therapies for ionizing radiation associated skin fold carcinogenesis. Expert Opinion in Pharmacology, 10(5), 813-821.
Pignol, J.P., Olivotto, I., Rakovitch, E., Gardner, S., Sixel, K., Beckham, W., Vu, T.T.T., Truong, P., Ackerman, I., & Paszat, L., (2008). A multicenter randomized trial of breast intensity-modulated radiation therapy to reduce acute radiodermatitis. Journal of Clinical Oncology, 26(13), 2085-2092. DOI: 10.1200/jco.2007.15.2488
Radiation Therapy Oncology Group (2010). Acute radiation morbidity scoring criteria. Retrieved from: www.rtog.org/members/toxicity/acute.html#skin
Radiation Therapy Oncology Group (2010). RTOG/EORTC late radiation morbidity scoring schema. Retrieved from www.rtog.org/members/toxicity/late.html
Richardson, J., Smith, J.E., McIntyre, M., Thomas, R.,& Pilkington, K. (2005). Aloe vera for preventing radiation-induced skin reactions: A systematic literature review. Clinical Oncology, 17, 478-84. DOI:10.1016/j.clon.2005.04.013
Russi, E.G., Merlano, M.C., Comino, A., & Numico, G. (2007). Ultrathin hydrocolloid dressing in skin damaged from alternating radiotherapy and chemotherapy plus cetuximab in advanced head and neck cancer (G.O.N.O. ALTERCC Italian trial): In regard to MacMillan et al. International Journal of Radiation Oncology, Biology, Physics, 68, 864-872.
Saeki, H., Furue, M., Furukawa, F., Hide, M., Ohtsuki, M., Katayama, I., Sasaki, R., Suto, H., & Takehara K. (2009). Guidelines for management of atopic dermatitis. Journal of Dermatology, 36(10), 563-577.
Stevens, D.L., & Eron, L.L. (2009). Cellulitis and soft-tissue infections. Annals of Internal Medicine, 150(1).
Theberge, V., Harel, F., Dagnault, A. (2009). Use of axillary deodorant and effect on acute skin toxicity during radiotherapy for breast cancer: A prospective randomized noninferiority trial. International Journal of Radiation Oncology, Biology, Physics, 75(4), 1048-1052.
Vavassis, P., Gelinas, M., Chabot, J., & Nguyen-Tan, P. (2008). Phase 2 study of silver leaf dressing for treatment of radiation-induced dermatitis in patients receiving radiotherapy to the head and neck. Journal of Otolaryngology-Head & Neck Surgery, 37 (1), 124-129. DOI: 10.2310/7070.2008.0020
Yarbro, C.H., Frogge, M.H., & Goodman, M. (Ed.). (2005). Cancer nursing: Principles and practice. Sudbury, MA: Jones and Bartlett Publishers.
Yeo, W., & Johnson, P.J. (2000). Radiation-recall skin disorders associated with the use of antineoplastic drugs: Pathogenesis, prevalence, and management. American Journal of Clinical Dermatology, 1(2), 113-116.